Реальные газы. Уравнение Ван-дер-Ваальса — Студопедия
Газовые законы, рассмотренные в предыдущих разделах, точно выполняются только для идеальных газов, которые не конденсируются при охлаждении их вплоть до абсолютного нуля температуры.
Свойства большинства газов близки к свойствам идеального газа, когда они находятся при температурах, достаточно далеких от точки конденсации, т. е. когда между молекулами отсутствует взаимодействие и когда собственный объем молекул газа мал по сравнению с объемом газа.
Вблизи точки конденсации (при высоком давлении и низкой температуре) свойство газов значительно отличается от свойств идеального газа. В этих случаях говорят о реальных газах.
Уравнение состояния для 1-го моля идеального газа (Vm– молярный объем) видоизменяется в случае реальных газов.
Для реальных газов необходим учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не  Объем b равен учетверенному собственному объему молекул.
Объем b равен учетверенному собственному объему молекул.
Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.
,
где a – постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения.
Вводя поправки в уравнение для идеального газа, получим уравнение Ван-дер-Ваальса для 1-го моля газа
. (9.45)
Учитывая, что , получим уравнение для произвольного количества вещества:
(9.46)
Поправки Ван-дер-Ваальса (a и b) являются постоянными для каждого газа величинами. Для их определения записывают уравнения для двух известных из опыта состояний газа и решаются относительно a и b.
Уравнение (9.45) можно записать в виде:
.
При заданных p и T – это уравнение третьей степени относительно Vm, следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причем физический смысл имеют лишь вещественные положительные корни.
Изотермами Ван-дер-Ваальса называются кривые зависимости p от Vm при заданных T, определяемые уравнением Ван-дер-Ваальса для моля газа.
При некоторой температуре Tk – критической температуре – на изотерме (рис. 9.11) только одна точка перегиба (в этой точке касательная к ней параллельна оси абсцисс). Точка K – критическая точка, соответствующие этой точке объем Vk и давление pk называются также критическими
При высокой температуре (T > Tk) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При низкой температуре (T<Tk) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
Рис. 9.11
Изотермам при низкой температуре (T < Tk) одному значению давления например,
Рассмотрим изотерму при T < Tkна рис. 9.12.
Рис. 9.12 Рис. 9.13
На участках 1–3 и 5–7 при уменьшении объема Vm давление p возрастает. На участке 3–5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3–5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма имеет вид ломанной линии 7–6–2–1.
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колокообразная кривая (рис. 9.13), ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму
Задачи к главам 8, 9
1. Рассмотрим модель идеального газа, заключенного в сосуд. Завышены или занижены по сравнению с реальным газом (при заданных V и Т) значения: а) внутренней энергии; б) давления газа на стенку сосуда?
 Внутренняя энергия некоторого газа 55 МДж, причем на долю энергии вращательного движения приходится 22 МДж. Сколько атомов в молекуле данного газа?
Внутренняя энергия некоторого газа 55 МДж, причем на долю энергии вращательного движения приходится 22 МДж. Сколько атомов в молекуле данного газа?3. Молекулы какого из перечисленных газов, входящих в состав воздуха, в равновесном состоянии обладают наибольшей средней арифметической скоростью? 1)N2; 2) О2; 3) H2; 4) CO2.
4. Некоторый газ с неизменной массой переводится из одного равновесного состояния в другое. Изменяется ли в распределении молекул по скоростям: а) положение максимума кривой Максвела; б) площадь под этой кривой?
5. Объем газа увеличивается, а температура уменьшается. Как изменяется давление? Масса постоянна.
6. При адиабатном расширении газа объем его изменяется от V1 до V2. Сравнить отношения давлений (p1/p2), если газ: а) одноатомный; б) двухатомный.
7. Аэростат с эластичной герметической оболочкой поднимается в атмосфере. Температура и давление воздуха уменьшаются с высотой. Зависит ли подъемная сила аэростата: а) от давления воздуха; б) от температуры?
Температура и давление воздуха уменьшаются с высотой. Зависит ли подъемная сила аэростата: а) от давления воздуха; б) от температуры?
8. На рисунке изображены адиабаты для двух газов H2 и Ar. Указать какие графики соответствуют H
9. Сравнить работы расширения газа при изотермическом изменении объема от 1 до 2 м3 и от 2 до 4 м3.
10. Газ, расширяясь, переходит из одного и того же состояния с объемом V1 до объема V2: а) изобарно; б) адиабатно; в) изотермически. В каких процессах газ совершает наименьшую и наибольшую работы?
11. Какой из указанных газов при комнатной температуре имеет наибольшую удельную теплоемкость?
1) O2 ; 2) H2 ; 3) He; 4) Ne; 5) I2.
12. Как изменяется внутренняя энергия газа в процессах расширения: а) в изобарном; б) в адиабатном?
13. Дан неизвестный газ. Можно ли узнать, какой это газ, если заданны:
а) p, V, T, m; б) p, T, r; в) g, СV ? К газу применима классическая теория теплоемкостей.
14. Определить знаки молярной теплоемкости газа (m=const, молекулы газа жесткие) в процессе, для которого T2V=const, если газ: а) одноатомный; б) двухатомный.
15. Перейдем от модели идеального газа к модели, в которой учитываются силы притяжения между молекулами. Как изменяются молярные теплоемкости CV и Cpпри заданных V и T?
16. Идеальный газ, содержащий N молекул, расширяется при постоянной температуре. По какому закону увеличивается число микросостояний газа w? 1) w~V; 2) w~VN; 3) w~ lnV; 4) не приведено верного соотношения.
Для описания свойств реальных газов — Студопедия
Удивительно, что при всей простоте уравнения Ван-дер-Ваальса, оно дает ясное, качественно правильное описание превращений в системе жидкость-газ. Однако в количественном отношении предсказания на его основе отклоняются от экспериментальных результатов:
• Исходное положение о том, что параметры a и b являются константами для каждого вещества, не оправдалось.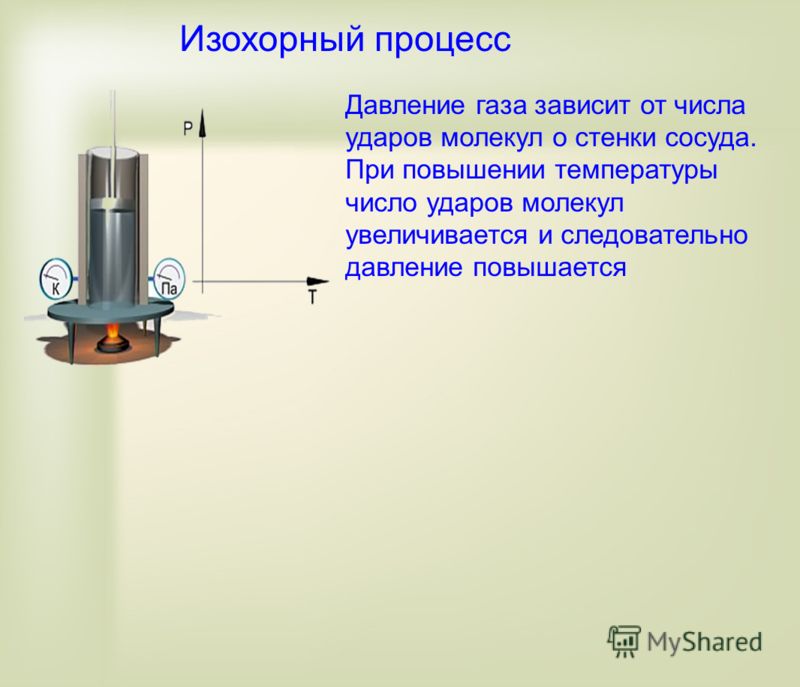
• Полученное значение критического параметра меньше чем экспериментальное значение для различных веществ. Уравнение Ван-дер-Ваальса лучше описывает легкие газы, чем тяжелые.
• Соотношение не выполняется. Более точным соотношением является соотношение .
• В области сильно сжатых газов и жидкостей, включая область двухфазных состояний, уравнение Ван-дер-Ваальса не имеет теоретического обоснования и приводит к значительным количественным расхождениям с опытом.
14.3. Внутренняя энергия газа Ван-дер-Ваальса
Внутренняя энергия газа может быть представлена суммой кинетической энергии молекул, зависящей от температуры, и потенциальной энергии взаимного притяжения частиц. Если предположить, что теплоемкость не зависит от температуры, то первое слагаемой будет равно .
Мерой потенциальной энергии притяжения является работа (с противоположным знаком), которую надо затратить для того, чтобы развести молекулы на бесконечно большое расстояние друг от друга. Молярную работу против сил внутреннего давления газа рассчитаем как макроскопическую работу
Молярную работу против сил внутреннего давления газа рассчитаем как макроскопическую работу
соответственно
Таким образом, внутренняя энергия одного моля газа Ван-дер-Ваальса определяется формулой
где и – молярные величины.
Выражение для энергии (14.11) можно получить и чисто термодинамическим методом согласно (12.25) на основе термического уравнения состояния газа (14.1). Для молей газа калорическое уравнение состояния имеет следующий вид
Отметим, что полученные выражения для энергии газа Ван-дер-Ваальса справедливы только для физически однородного вещества. Для двухфазных состояний они не применимы. Хотя иногда используются для количественных оценок некоторых параметров.
Анализ формул (14.11) и (14.12) показывает, что при расширении газа в вакуум в условиях адиабатической изоляции, он охлаждается. Подобное явление не может произойти в идеальном газе.
В реальном газе это происходит потому, что хотя газ и не совершает работу против внешних сил. Он совершает работу против внутренних сил молекулярного притяжения за счет уменьшения средней кинетической энергии частиц. Вследствие этого температура газа понижается.
Он совершает работу против внутренних сил молекулярного притяжения за счет уменьшения средней кинетической энергии частиц. Вследствие этого температура газа понижается.
14.4. Эффект Джоуля-Томсона
Основные определения
Многолетние совместные исследования Джоуля и В.Томсона (с 1852 по 1862 гг.) позволили им не только экспериментально подтвердить зависимость внутренней энергии реального газа от его объема. Было открыто важное физическое явление, получившее название эффекта Джоуля-Томсона.
Явление заключается в изменении температуры реального газа при его медленном протекании через пористую перегородку (пробку) в условиях адиабатической изоляции. Стационарное течение газа через пробку называется процессом Джоуля-Томсона, а изменение температуры газа при таком течении дифференциальным эффектом Джоуля-Томсона. Наряду с дифференциальным эффектом существует также интегральный эффект Джоуля-Томсона. Интегральный эффект наблюдается в процессе дросселирования газа, т. е. протекания его через вентиль (малое отверстие), по разные стороны которого давление отличается на несколько порядков, т.е. в сотни или тысячи раз.
е. протекания его через вентиль (малое отверстие), по разные стороны которого давление отличается на несколько порядков, т.е. в сотни или тысячи раз.
Если газ при расширении охлаждается , то эффект Джоуля-Томсона называется положительным, а если газ при расширении нагревается , то эффект называется отрицательным. Определения положительного и отрицательного эффектов относятся, как к дифференциальному, так и к интегральному эффекту Джоуля-Томсона.
Описание процесса Джоуля-Томсона
В опыте используется теплоизолированная трубка, разделенная посередине пористой перегородкой, например, пробкой из ваты. По обе стороны пробки находится реальный газ (рис. 14.2). Под действием разности давлений, создаваемой с помощью поршней П1 и П2, исследуемый газ медленно протекает через пробку из одной части трубки в другую. Давление газа и по разным сторонам пробки поддерживаются постоянными.
Рис. 14.2. 14.2.
|
Несмотря на медленность течения, этот процесс необратим, так как система в целом не является равновесной. Энтропия в изолированной системе возрастает.
Попробуем разобраться, какая функция состояния в этом процессе остается неизменной. Пусть один моль газа при давлении (до пробки) занимает объем . Для того, чтобы переместить этот газ через пробку надо затратить работу внешних сил . Расширяясь после прохождения пробки до объема при давлении , сам газ совершает работу .
Запишем уравнение первого начала термодинамики применительно к рассматриваемому процессу с учетом наличия теплоизолирующей оболочки
или, что, то же самое,
Посмотрите внимательно на выражение (14.14). Узнаёте? Конечно, здесь написано, что энтальпия «до того» равно энтальпии «после того». Таким образом, в процессе Джоуля-Томсона
Таким образом, в процессе Джоуля-Томсона
Полученное условие постоянства энтальпии является принципиально важным для вычисления эффекта Джоуля-Томсона.
Сущность эффекта Джоуля-Томсона
Природу этого эффекта можно понять на основе анализа зависимости потенциала межмолекулярного взаимодействия от расстояния между частицами (рис. 13.2). Наличие минимума на кривой Леннарда-Джонса указывает на то, что слева от производная , правее .
Поскольку сумма потенциальной энергии взаимодействия и кинетической энергии величина постоянная, то получаем простое соотношение
Теперь рассмотрим два случая.
1. Пусть температура газа и его плотность настолько велики, что среднее расстояние между молекулами меньше чем : . Тогда
, а , это значит, что кинетическая энергия газа при расширении увеличивается, т.е. его температура повышается. В этом и заключается суть отрицательного эффекта Джоуля-Томсона.
2. Пусть температура газа и его плотность настолько низки, что . Тогда
Тогда
, а , следовательно, кинетическая энергия газа при расширении уменьшается, т.е. его температура понижается. Наблюдается положительный эффект Джоуля-Томсона.
Следовательно, один и тот же газ при одних условиях ( , – «велики») будет после протекания через пробку нагреваться, а при других условиях ( , – «малы») – охлаждаться. Из приведенных рассуждений также очевидно, что в идеальном газе эффект Джоуля-Томсона невозможен.
Расчет дифференциального эффекта Джоуля-Томсона
Получим формулу эффекта Джоуля-Томсона методом термодинамических потенциалов. Выберем в качестве независимых переменных и и запишем условие (14.15) в дифференциальной форме
Сделаем замену
Последнее равенство получается из (12.10) и соотношения Максвелла, имеющего вид
Окончательно из (14.16) получаем
Это и есть искомая формула для дифференциального эффекта Джоуля-Томсона.
Температура, при которой , т. е. происходит изменение знака эффекта Джоуля-Томсона, называется температурой инверсии.
е. происходит изменение знака эффекта Джоуля-Томсона, называется температурой инверсии.
Вычисление величины эффекта по формуле (14.17) неизбежно связано с вычислением производной , что требует знания термического уравнения состояния исследуемого реального газа. При вычислении эффекта в разреженном газе Ван-дер-Ваальса получается следующее выражение
Приравняв к нулю правую часть (14.18), получим температуру инверсии газа Ван-дер-Ваальса:
Температура инверсии определяется индивидуальными параметрами исследуемого газа. Если температура газа больше чем , то газ при расширении нагревается (отрицательный эффект), а если его , то газ охлаждается (положительный эффект).
Для большинства газов . Например, для кислорода =1063 K, для углекислого газа = 2073 K. Поэтому, если начальная температура газов равна комнатной , то для них наблюдается положительный эффект: газы охлаждаются.
Для таких газов как водород и гелий . Для водорода = 200 K. Эти газы в процессе Джоуля – Томсона при начальной комнатной температуре нагреваются (отрицательный эффект). Заметим, что в дифференциальном эффекте изменение температуры для обычных газов составляет сотые или десятые доли K. В связи с этим измерение эффекта представляет не простую экспериментальную задачу.
Для водорода = 200 K. Эти газы в процессе Джоуля – Томсона при начальной комнатной температуре нагреваются (отрицательный эффект). Заметим, что в дифференциальном эффекте изменение температуры для обычных газов составляет сотые или десятые доли K. В связи с этим измерение эффекта представляет не простую экспериментальную задачу.
Расчет интегрального эффекта Джоуля-Томсона
Процесс дросселирования газа не является равновесным процессом. Однако начальное и конечное состояния газа являются равновесными и полностью определяются заданием энтальпии и давления. При вычислении изменения температуры реального процесса его заменяют идеальным квазистатическим процессом, происходящим при постоянной энтальпии. Другими словами, интегральный эффект Джоуля-Томсона представляют непрерывной последовательностью дифференциальных эффектов. При таком подходе получаем выражение
Это и есть формула интегрального эффекта. В ряде случаев интегральный эффект можно рассчитать непосредственно на основе условия (14. 15).
15).
Запишем энтальпию газа Ван-дер-Ваальса до дросселирования и после него и приравняем эти величины: . Будем полагать, что после дросселирования к газу применима модель идеального газа, тогда
Формула (14.21) описывает интегральный эффект для газа Ван-дер-Ваальса. Из условия , получим выражение для температуры инверсии
Кривая инверсии изображена на рис. 14.3. Как видно с увеличением плотности газа уменьшается
Рис. 14.3.
У достаточно разреженного газа температура инверсии равна , что совпадает с дифференциального эффекта. Поведение кривой инверсии (рис. 14.3) характерно для всех реальных газов, это следует из закона соответственных состояний.
Величина интегрального эффекта может достигать десятков и сотен . Так, дросселирование водорода может привести к сильному нагреванию газа, в некоторых случаях даже сопровождающемуся взрывом баллона или трубы. А вот дросселирование углекислого газа приводит к такому понижению его температуры, что он при атмосферном давлении переходит в твердое агрегатное состояние – сухой лед.
Интегральный эффект Джоуля-Томсона имеет очень важное практическое значение: наряду с адиабатическим расширением этот эффект используется для получения низких температур.
14.5. Методы получения низких температур
Формирование представлений о низких температурах, их получение и измерение относится к началу XVIII века. Однако прошло почти два века прежде чем низкие температуры стали мощным инструментом исследования вещества. Началом физики низких температур как раздела физики, изучающего свойства вещества и процессы при температурах вблизи абсолютного нуля, следует считать 1908 год. Именно в этом году в Лейденской криогенной лаборатории под руководством Х.Камерлинг-Оннеса было осуществлено сжижение гелия и началось исследование свойств различных веществ при гелиевых температурах (4,2 ÷ 1 ).
К настоящему времени в физике сложилась следующее подразделение основных температурных диапазонов:
1. Криогенные температуры – Т < 80 .
2. Низкие температуры – Т < 0,3 .
Низкие температуры – Т < 0,3 .
3. Сверхнизкие температуры – 10-3 ÷10-6 и ниже.
На схеме 14.5.1. представлены методы получения криогенных температур в различных интервалах.
Схема14.5.1.
Методы получения криогенных температур
Интервал температур, K
Физические основы методов
Адиабатическое расширение и эффект Джоуля-Томсона
и ниже
Растворение жидкого 3He в жидком гелии 4He(поглощается теплота растворения)
Метод адиабатического размагничивания парамагнитных атомов и ядерных спинов.
Широкий спектр проблем получения криогенных температур и способы их решения представлены в книге Петра Леонидовича Капицы [7] в главе «Криогенная техника».
Остановимся более подробно на обсуждении двух наиболее распространенных методах получения криогенных температур.
Реальный газ, основные понятия и формулы
Что такое реальный газ
Уравнение Менделеева-Клапейрона описывает параметры состояния разреженных газов (находящихся при не слишком больших давлениях и при достаточно высоких температурах). При обычных условиях (т.е. при комнатной температуре и атмосферном давлении) это уравнение применимо ко многим газам (например, таким как азот и кислород). Наиболее близки по своим свойствам к идеальному газу гелий и водород. При низких температурах и высоких давлениях поведение газа начинает существенно отличаться от поведения идеального газа. С повышением плотности газа процессы столкновений играют все большую роль, поэтому размерами молекул и их взаимодействием пренебрегать уже нельзя.
Взаимодействие между молекулами реального газа носит сложный характер, поэтому получить уравнение состояния, которое бы количественно правильно описывало поведение реального газа во всей области возможных изменений его температуры и плотности, не представляется возможным. Можно, однако, записать приближенное уравнение, которое учитывает основные качественные особенности взаимодействия молекул.
Можно, однако, записать приближенное уравнение, которое учитывает основные качественные особенности взаимодействия молекул.
Уравнение Ван-дер-Ваальса
Поправка учитывает быстро возрастающие на малых расстояниях силы отталкивания: молекулы как бы занимают определенный объем, меньше которого газ не может быть сжат. Таким образом, поправка к объему характеризует ту часть объема, которая недоступна для движения молекул и равна нескольким суммарным объемам всех молекул, содержащихся в газе.
Поправку
называют внутренним молекулярным давлением. Эта поправка учитывает притяжение молекул, следствием которого является уменьшение давления газа. Молекулы идеального газа, сталкиваясь со стенками сосуда, оказывают на него давление. При учете притяжения на каждую подлетевшую к стенке молекулу действует сила, «отталкивающая» ее от стенки обратно в объем – сила притяжения молекул объема. Это притяжение молекул со стороны объема ослабляет силу удара молекул о стенку, при этом давление на стенку уменьшается на величину .
Значенияпостоянных Ван-дер-Ваальса a и b зависят от природы газа, но не зависят от температуры, Константа (параметр) a характеризует взаимодействие между молекулами на больших расстояниях – дальнодействие сил, параметр b характеризует взаимодействии на малых расстояниях – близкодействие сил взаимодействия.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Уравнение Ван-дер-Ваальса в физике
При низких давлениях и высоких температурах закон Менделеева-Клапейрона также довольно точно описывает поведение реальных газов, однако в других условиях реальные газы значительно отклоняются от идеальности. Уравнение Ван-дер-Ваальса учитывает эти отклонения.
Уравнение Ван-дер-Ваальса учитывает эти отклонения.
Формула уравнения Ван-дер-Ваальса
Уравнение Ван-дер-Ваальса имеет вид:
В этом уравнении n – количество молей газа, р – его давление, V – занимаемый газом объем, Т – абсолютна температура газа. Универсальная газовая постоянная имеет значение 8,31441 Дж/(моль•К), одинаковое для всех газов.
Переменная а – это поправка на силу притяжения между молекулами газа. Под действием этой силы молекулы притягиваются друг к другу, внутрь газа, уменьшая давление на стенку. Переменная b – поправка, учитывающая собственный объем, занимаемый молекулами газа. Эти поправки зависят от вида газа, и могут быть найдены из таблиц либо рассчитаны по следующим формулам:
Здесь и – это давление и абсолютная температура газа в критической точке, то есть в точке перехода газообразной фазы в жидкую.
В реальном газе расстояния между молекулами меньше, чем в идеальном, и сравнимы с размерами самих молекул. Поэтому силы взаимодействия между молекулами становятся достаточно большими. В объеме газа молекула со всех сторон окружена другими молекулами, и силы их притяжения уравновешиваются. Однако когда молекула приближается к стенке, силы притяжения больше не уравновешиваются и «втягивают» её внутрь. Поэтому молекула движется к стенке медленнее, из-за чего давление на стенку уменьшается. Это и учитывает поправка а.
Поэтому силы взаимодействия между молекулами становятся достаточно большими. В объеме газа молекула со всех сторон окружена другими молекулами, и силы их притяжения уравновешиваются. Однако когда молекула приближается к стенке, силы притяжения больше не уравновешиваются и «втягивают» её внутрь. Поэтому молекула движется к стенке медленнее, из-за чего давление на стенку уменьшается. Это и учитывает поправка а.
Кроме того, за счёт сил межмолекулярного взаимодействия реальные газы способны переходить в жидкое состояние, и уравнение Ван-дер-Ваальса довольно точно описывает поведение газов вблизи этого перехода.
Так как в реальном газе расстояние между молекулами сравнительно невелико, молекула должна пролететь меньшее расстояние, чтобы удариться о стенку. Поэтому при очень больших давлениях давление на стенку возрастает, и это учитывает поправка b.
Уравнение Ван-дер-Ваальса применяется, в частности, при определении параметров пара в теплотехнике и теплотехнике, при исследовании сжижения газов.
Примеры решения задач
что это, единица измерения, от чего зависит, как вычислить, формулы МКТ
Давление газа — что это за параметр
ОпределениеДавление в физике представляет собой один из трех ключевых термодинамических макроскопических характеристик для измерения любой газовой системы.
ОпределениеГаз — это одно из четырех, включая плазму, агрегатных состояний материи, характеризующееся очень слабыми связями между составляющими его частицами, а также их большой подвижностью.
В газообразной среде частицы в определенной концентрации расположены не упорядоченно и перемещаются в хаотичном порядке в разных направлениях с одинаковой вероятностью. Подобное строение не позволяет газам сохранять стабильность объема и формы даже при малом внешнем силовом воздействии. Для любого газа, включая одноатомный, значение средней кинетической энергии его частиц в виде атомов и молекул будет превышать энергию межмолекулярного взаимодействия между ними.
Кроме того, расстояние, на которое удалены частицы, значительно превышает их собственные размеры. В том случае, когда молекулярными взаимодействиями и габаритами частиц допускается пренебрегать, газ считают идеальным. Для такой формы материи характерен только один тип внутреннего взаимодействия в виде упругих столкновений. Так как размер частиц пренебрежимо мал по сравнению с расстоянием, на которое они удалены, вероятность столкновений частиц между собой будет низкой.
ПримечаниеПо этой причине в идеальной газовой среде можно наблюдать лишь столкновения частиц со стенками сосуда. Какой-либо реальный газ с хорошей точностью можно отнести к идеальному, когда их температура выше, чем комнатная, а давление несущественно больше, чем атмосферное.
Причина возникновения давления в газах
Давление газа нельзя объяснить теми же причинами, что и давление твердого тела на опору. Расстояние, на которое удалены молекулы газообразной среды, существенно больше. В результате хаотичного движения они сталкиваются между собой и со стенками сосуда, который они занимают. Давление газа на стенки сосуда и вызвано ударами его молекул.
В результате хаотичного движения они сталкиваются между собой и со стенками сосуда, который они занимают. Давление газа на стенки сосуда и вызвано ударами его молекул.
Данный параметр увеличивается по мере того, как нарастает сила ударов молекул о стенки. Газ характеризуется одинаковым давлением во всех направлениях, которое является следствием хаотичного движения огромного числа молекул.
ПримечаниеВажно отметить, что газ оказывает давление на дно и стенки сосуда, объем которого он занимает, во всех направления равномерно. В связи с этим, воздушный шарик сохраняет форму, несмотря на то, что его оболочка достаточно эластична.
Перед тем как транспортировать или отправить на хранение газообразные вещества, их сильно сжимают. В этом случае давление газа увеличивается. Его помещают в специальные баллоны из стали высокой прочности. Такие емкости необходимы для хранения сжатого воздуха на подводных лодках и кислорода, предназначенного для сварки металлов.
Свойства давления газа:
- Если объем уменьшается, то давление газа возрастает, а во время увеличения объема, давление будет снижаться при постоянных величинах массы и температуры вещества.
- Газ, находящийся в закрытом сосуде, характеризуется давлением, которое возрастает по мере увеличения температуры вещества при условии постоянства его массы и объема.
- В том случае, когда масса газа увеличивается, его давление также будет возрастать и наоборот.
Запись формул для определения давления газа начинают с выяснения причин, по которым оно возникает в рассматриваемой системе. Исходя из физического смысла, давление представляет собой величину, равную отношению силы, перпендикулярно воздействующей на некоторое основание, к площади этого основания:
\(P=\frac{F}{S}\)
Как было отмечено ранее, для идеальной газовой системы характерен лишь один тип взаимодействия — это абсолютно упругие столкновения. В процессе частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. В данном случае применим второй закон Ньютона:
В процессе частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. В данном случае применим второй закон Ньютона:
\(F*Δt = Δp\)
Таким образом, конкретно сила F является причиной формирования давления на стенки сосуда. Данная величина F, производимая одной частицей, незначительна. Однако, когда количество частиц огромно, они в совокупности создают ощутимый эффект, проявляемый в виде наличия давления в сосуде.
Формула давления идеального газа из молекулярно-кинетической теории
Объяснение концепции идеального газа построено на основных положениях молекулярно-кинетической теории, которая вытекает из принципов статистической механики. Наука получила активное развитие во второй половине XIX, благодаря таким ученым, как Джеймс Максвелл и Людвиг Больцман. Основы дисциплины были заложены еще Бернулли в первой половине XVIII века.
Исходя из статистики Максвелла-Больцмана, все частицы в системе обладают разными скоростями движения. {2}}{3*V}\)
{2}}{3*V}\)
где N является количеством частиц в системе; V обозначает объем; v представляет собой среднюю квадратичную скорость; m является массой одной частицы.
При наличии указанных в формуле параметров, выраженных в единицах СИ, можно вычислить давление газа в сосуде.
Второй способ записи основного уравнения МКТ
ОпределениеВ середине 30-х годов XIX столетия французскому инженеру Эмилю Клапейрону удалось обобщить накопленный до этого времени экспериментальный опыт изучения поведения газов во время разнообразных изопроцессов и получить формулу, которую в будущем назвали универсальным уравнением состояния идеального газа:
\(P*V = n*R*T \)
n является количеством вещества в молях; T представляет собой температуру по абсолютной шкале и обозначается в кельвинах.
Величина R является универсальной газовой постоянной. Этот термин был введен в уравнение русским химиком Д.И. Менделеевым. Исходя из этого, запись уравнения называют законом Клапейрона-Менделеева.
С помощью данного выражения можно определить формулу для расчета давления газа:
\(P=\frac{n*R*T}{V}\)
Полученное уравнение объясняет линейный рост давления при увеличении температуры в условиях стабильности объема. Если объем уменьшается с сохранением температуры, то давление увеличивается по гиперболе. Данные закономерности явления отражены в законах Гей-Люссака и Бойля-Мариотта.
Сравнивая представленное выражение с записью формулы, которая вытекает из положений молекулярно-кинетической теории, можно установить связь кинетической энергии одной частицы, либо системы в общем, и абсолютной температуры.
Важно отметить, что при расчетах с использованием формулы для Р, вытекающей из уравнения Клапейрона, связь с химическим составом газа отсутствует. Если давление определяют с помощью выражения, согласно понятию молекулярно-кинетической теории, то данную связь следует учитывать в виде параметра m. В том случае, когда определяют давление смеси идеальных газов, применяют один из следующих методов:
- Расчет средней массы частиц m, либо среднего значения молярной массы М с учетом атомных процентов каждого газа в смеси.
 {2}}{3*V}\)
{2}}{3*V}\)Таким образом, удельный объем сосуда в кубических метрах равен 0,01. Молярная масса молекулы кислорода М составляет 0,032 кг/моль. Данные параметры можно подставить в уравнение вместе со скоростью и количеством вещества. Тогда Р = 533333 Па, что представляет собой давление в 5,3 атмосферы.
Уравнение Ван-дер-Ваальса, физический смысл поправок. Изотермы Ван-дер-Ваальса и их сравнение с экспериментальными изотермами
⇐ ПредыдущаяСтр 9 из 13Следующая ⇒Для реальных газов необходимо ввести поправки в уравнение состояния идеального газа, учитывающие объем молекул и силы их взаимодействия. Эти поправки были учтены голландским физиком Ван-дер-Ваальсом. Часть объема V газа занята самими молекулами. Поэтому объем, занимаемый газом, должен быть уменьшен на величину b, пропорциональную объему молекул:
, (1)
где – постоянная Авогадро, – диаметр молекулы. Теоретические расчёты показывают, что величина b в четыре раза превосходит объем молекул.

В реальных газах имеются силы взаимного притяжения молекул, которые действуют дополнительно к силам внешнего давления и как бы сжимают газ. Вследствие этого возникает добавочное внутреннее давление , которое пропорционально квадрату концентрации молекул или обратно пропорционально квадрату объема газа:
, (2)
где
, (3)
– потенциальная энергия притяжения двух молекул ( ).
Принимая данные обстоятельства во внимание, уравнение состояния реального газа принимает следующий вид:
, (4)
где а, – константы, определяемые экспериментальным путём, –количество вещества, – универсальная газовая постоянная.
Изотермы
Исследование уравнения (4) удобно производить, рассматривая изотермы Ван-дер-Ваальса. Анализируя графики на рис. 1, можно сделать три вывода.
Рис.  1
1
1. При высоких температурах (например, T1, которой соответствует изотерма 1) изобара AD пересекает изотерму в одной точке. Уравнение Ван-дер-Ваальса имеет один вещественный корень, т.е. каждому значению T соответствует единственное значение объема. Из этого следует, что при высоких температурах вещество находится в однофазном – газообразном состоянии.
2. Невысоким температурам соответствуют изотермы 2, 3, 4, на которых имеются перегибы. Изобара AD пересекает изотерму 4 в трех точках А, B, C. В уравнении Ван-дер-Ваальса это состояние соответствует трём вещественным значениям объема при данных p и T. Это означает, что вещество находится в трёх фазовых состояниях. Под фазойпонимают совокупность всех частей системы, обладающих одинаковыми физическими и химическими свойствами.
3. Переход изотермы 5 к изотермам 4, 3 и т. д., соответствующий повышению температуры, приводит к тому, что изгибы на изотермах сглаживаются.
 Расстояние, например, между точками A и C уменьшается и уже на изотерме 2 они сливаются в одну точку – точку К перегиба. В точке перегиба изобара является касательной к изотерме. Температура Tк, соответствующая этой изотерме называется критической температурой.
Расстояние, например, между точками A и C уменьшается и уже на изотерме 2 они сливаются в одну точку – точку К перегиба. В точке перегиба изобара является касательной к изотерме. Температура Tк, соответствующая этой изотерме называется критической температурой.Экспериментальные изотермы (рис. 2) могут быть получены путём сжатия газа в изотермических условиях. Экспериментальные и теоретические изотермы на участках 1 – 2 и 3 – 4 с известным приближением можно считать совпадающими. При особых условиях эксперимента могут быть получены участок 2 – 2/, соответствующий пересыщенному пару, и участок 3 – 3/, относящийся к перегретой жидкости. Это малоустойчивые, метастабильные состояния.
Рис. 2 Метастабильным состоянием называется равновесное состояние с ограниченной устойчивостью. При отклонении от этого состояния вещество не стремится к нему обратно, а легко переходит в другое устойчивое состояние.
 Метастабильные состояния существуют ограниченное время. Чтобы получить такое метастабильное состояние как перегретый пар необходимо отсутствие в газе инородных и смачиваемых включений, которые являются центрами конденсации. Перегретой может быть только очень чистая жидкость, в которой нет зародышей газовой фазы. Как правило, они всегда присутствуют в виде мельчайших пузырьков на стенках сосуда, содержащего жидкость, или на взвешенных в жидкости пылинках.
Метастабильные состояния существуют ограниченное время. Чтобы получить такое метастабильное состояние как перегретый пар необходимо отсутствие в газе инородных и смачиваемых включений, которые являются центрами конденсации. Перегретой может быть только очень чистая жидкость, в которой нет зародышей газовой фазы. Как правило, они всегда присутствуют в виде мельчайших пузырьков на стенках сосуда, содержащего жидкость, или на взвешенных в жидкости пылинках.Вещество на участке 2 – 3 находиться в двухфазном состоянии, т. е. часть первоначального газообразного вещества превратилась в жидкость, а часть осталась в газообразном состоянии. Соответствующее участку 2 – 3 давление называется давлением насыщения. Точка 3 (рис. 2) соответствует состоянию, когда весь газ превращается в жидкость.
С ростом температуры участки, соответствующие двухфазному состоянию, становятся уже (рис. 3). Затем появляется изотерма, на которой этот участок превращается в точку перегиба К; ей соответствует критическая температура.
 При температурах ниже критической есть участок насыщения, и вещество может переходить из газообразного состояния в жидкое состояние (область I, рис. 3). Температурам выше критической соответствует только газообразное состояние (область II, рис. 3). Область III, примыкающая к оси ординат (рис. 3), относится к жидкому состоянию системы.
При температурах ниже критической есть участок насыщения, и вещество может переходить из газообразного состояния в жидкое состояние (область I, рис. 3). Температурам выше критической соответствует только газообразное состояние (область II, рис. 3). Область III, примыкающая к оси ординат (рис. 3), относится к жидкому состоянию системы.Рис. 3 Критическая температура – это наивысшая температура, при которой газ может ещё быть превращён в жидкость. Давление и объем, соответствующие точке перегиба К, называются критическими. При критическом состоянии вещества различия в свойствах пара и жидкости отсутствуют. Критическое состояние характеризуется непрерывным переходом пара в жидкость и жидкости в пар. При этом удельная теплота парообразования и коэффициент поверхностного натяжения равны нулю. Параметры критического состояния вещества связаны с постоянными Ван-дер-Ваальса и :
, , , (5)
или
, .

Читайте также:
внутреннее давление газа — это … Что такое внутреннее давление газа?
Газовая хроматография — Газовый хроматограф с пробоотборником над паром Acronym GLC, GC Классификация хроматография Аналиты органические неорганические… Wikipedia
Ракета реактора с газовым сердечником — Ракета с реактором с газовым сердечником представляет собой концептуальный тип ракеты, которая приводится в движение отработанным теплоносителем газового реактора деления. Активная зона ядерного реактора деления может быть газовой или плазменной.Они могут быть способны создавать определенные импульсы… Wikipedia
газ — безгазовый, прил. / газ /, н., пл. газы, v., газированные, газовыделение. п. 1. Физика. вещество, обладающее совершенной молекулярной подвижностью и свойством неограниченного расширения, в отличие от твердого вещества или жидкости.
 2. любая такая жидкость или смесь жидкостей. 3. любой…… Универсал
2. любая такая жидкость или смесь жидкостей. 3. любой…… УниверсалГаз — Эта статья о физических свойствах газа как состояния материи. Для использования газов и других значений см. Газ (значения).Га… Википедия
Газожидкостная хроматография — Infobox название химического анализа = Газожидкостная хроматография Заголовок = Газовый хроматограф с пробоотборником в свободном пространстве акроним = ГЖХ, классификация ГХ = хроматографические аналиты = органические неорганические должны быть летучими производители = Agilent (дочерняя компания … Википедия
Газовый баллон — Для получения информации о механических устройствах, используемых для передачи силы от жидкости или газа под давлением, см. Пневматический баллон.Для крупных сооружений, используемых для хранения городского газа, см. Газгольдер. Промышленные баллоны со сжатым газом, используемые для газокислородной сварки и резки… Wikipedia
Сосуд под давлением — Вертикальные сосуды под давлением, установленные в конструкции Сосуд под давлением — это закрытый контейнер, предназначенный для хранения газов или жидкостей под давлением, существенно отличающимся от давления окружающей среды.
 Перепад давления опасен и многие смертельны…… Wikipedia
Перепад давления опасен и многие смертельны…… WikipediaИзмерение давления — Конструкция манометра с трубкой Бурдона, конструкционные элементы изготовлены из латуни. Для измерения давления и вакуума было разработано множество методов.Инструменты, используемые для измерения давления, называются манометрами или вакуумметрами. А…… Википедия
Газонаполненная трубка — См. Также: Газоразрядная лампа Наполненная газом трубка, также известная как газоразрядная трубка, представляет собой расположение электродов в газе внутри изолирующей термостойкой оболочки. Хотя оболочка обычно стеклянная, в электрических лампах часто используются…… Wikipedia
Газораспределительная сеть — это система внешних трубопроводов от источника до линии обслуживания потребителей газа, а также сооружения и инженерные устройства к ним.Внешний трубопровод — это подземный, надземный и / или воздушный трубопровод, проложенный за пределами зданий, чтобы…… Глоссарий нефти и газа
Внутренняя баллистика — Внутренняя баллистика, подраздел баллистики, представляет собой исследование поведения снаряда с момента включения воспламенителя метательного заряда до момента его выхода из ствола орудия.
 Изучение внутренней баллистики важно для разработчиков и пользователей…… Wikipedia
Изучение внутренней баллистики важно для разработчиков и пользователей…… Wikipedia- Для описания и измерения давления газа.
- лежа?
- стоит на краю в книжном шкафу?
A Мы рассчитали силу как 19,6 Н. Когда книга лежит горизонтально, площадь составляет (0,270 м) (0.210 м) = 0,0567 м 2 .
P = 19,6 N 0,0567 м2 = 3,46 × 102 Па B Давление, которое оказывает горизонтально лежащий текст, составляет
B Давление, которое оказывает горизонтально лежащий текст, составляетA Если книга стоит на конце, сила остается прежней, но площадь уменьшается:
(21,0 см) (4,5 см) = (0,210 м) (0,045 м) = 9,5 × 10 −3 м 2B Давление книги в этом положении, таким образом, составляет
Р = 19.6 Н9,5 × 10−3 м2 = 2,1 × 103 ПаТаким образом, давление , , оказываемое книгой, изменяется примерно в шесть раз в зависимости от ее ориентации, хотя сила , оказываемая книгой, не меняется.
- при стоянии в лаборатории на плоской подошве в теннисных туфлях (площадь подошвы примерно 180 см.
 2 )?
2 )? - , когда она ступает пяткой вперед на танцпол в туфлях на высоком каблуке (площадь пятки = 1.0 см 2 )?
- 3,27 × 10 4 Па (4,74 фунта / дюйм 2 )
- 5,9 × 10 6 Па (8,5 × 10 2 фунтов / дюйм 2 )
- атмосферы.
- килопаскалей.
- миллиметра ртутного столба.
- килопаскалей.
- Давление определяется как сила, действующая на единицу площади; его можно измерить с помощью барометра или манометра.
Какие четыре величины должны быть известны, чтобы полностью описать образец газа? Какие единицы обычно используются для каждого количества?
Если приложенная сила постоянна, как изменяется давление, оказываемое объектом, по мере уменьшения площади, на которую действует сила? Как это соотношение применимо в реальном мире к простоте забивания маленького гвоздя по сравнению с большим гвоздем?
По мере увеличения силы, действующей на фиксированный участок, давление увеличивается или уменьшается? Имея это в виду, ожидаете ли вы, что тяжелому человеку понадобятся снегоступы большего или меньшего размера, чем более легкому человеку? Объясни.

Что мы подразумеваем под атмосферным давлением ? Атмосферное давление на вершине горы. Ренье больше или меньше давления в Майами, Флорида? Зачем?
Где самое высокое атмосферное давление — пещера в Гималаях, шахта в Южной Африке или пляжный домик во Флориде? У кого самый низкий?
Марс имеет среднее атмосферное давление 0.007 атм. Будет ли на Марсе легче или труднее пить жидкость из соломинки, чем на Земле? Поясните свой ответ.
Давление, оказываемое массой 1,0 кг на площадь 2,0 м 2 , больше или меньше давления, оказываемого массой 1,0 кг на площадь 1,0 м 2 ? Какая разница, если таковая имеется, между давлением атмосферы на поршень 1,0 м 2 и поршень 2.
 0 м 2 поршень ?
0 м 2 поршень ?Если бы вы использовали воду в барометре вместо ртути, в чем было бы основное отличие прибора?
Поскольку давление определяется как сила на единицу площади ( P = F / A ), увеличение силы на данной площади увеличивает давление.Тяжелому человеку нужны снегоступы большего размера, чем более легкому. Распределение силы, действующей на более тяжелого человека под действием силы тяжести (то есть его веса), на большую площадь снижает давление, оказываемое на единицу площади, например квадратный дюйм, и снижает вероятность того, что он погрузится в снег.

Рассчитайте давление в атмосфере и килопаскалях в аквариуме, равное 2.0 футов в длину, 1,0 фута в ширину и 2,5 фута в высоту и содержит 25,0 галлонов воды в помещении с температурой 20 ° C; сам резервуар весит 15 фунтов (dh3O = 1,00 г / см 3 при 20 ° C). Если бы резервуар был 1 фут в длину, 1 фут в ширину и 5 футов в высоту, оказывал бы он такое же давление? Поясните свой ответ.

Рассчитайте давление в паскалях и атмосферах, оказываемое пакетом молока весом 1.5 кг и имеет основание 7,0 × 7,0 см. Если бы коробка лежала на боку (высота = 25 см), оказывала бы она большее или меньшее давление? Объясните свои рассуждения.
Если атмосферное давление на уровне моря составляет 1,0 × 10 5 Па, какова масса воздуха в килограммах над 1,0 см 2 участком вашей кожи, когда вы лежите на пляже? Если на вершине горы атмосферное давление составляет 8,2 × 10 4 Па, какова масса воздуха в килограммах выше 4?0 см 2 лоскут кожи?
Заполните следующую таблицу:
атм кПа мм рт.  Ст.
Ст.торр 1.40 723 43,2 Единицей давления в системе СИ является паскаль, равная 1 Н / м 2 .Покажите, как произведение массы объекта и ускорения свободного падения приводит к силе, которая при приложении к данной области приводит к давлению в правильных единицах СИ.
 Какая масса в килограммах, приложенная к площади 1,0 см 2 , требуется для создания давления
Какая масса в килограммах, приложенная к площади 1,0 см 2 , требуется для создания давления- 1,0 атм?
- 1,0 торр?
- 1 мм рт.
- 1 кПа?
Если вы построили манометр для измерения давления газа в диапазоне 0.60–1,40 атм. С использованием жидкостей, указанных в следующей таблице, какой высоты столбец вам понадобится для каждой жидкости? Плотность ртути 13,5 г / см 3 . На основании полученных результатов объясните, почему ртуть до сих пор используется в барометрах, несмотря на ее токсичность.
Плотность жидкости (20 ° C) Высота колонны (м) изопропанол 0.  785
785кокосовое масло 0,924 глицерин 1,259 5.4 кПа или 5,3 × 10 −2 атм; 11 кПа, 1,1 × 10 −3 атм; та же сила, действующая на меньшую площадь, приводит к большему
- Руководство для начинающих Домашняя страница
- Паскаль — сила в 1 ньютон (1 кг ускоряется со скоростью 1 м / сек.
 / сек) на 1 м 2
/ сек) на 1 м 2 - Миллибар —1000 раз больше силы 1 дина (1 г ускорения при 1 см / с / с), действующей на 1 см 2
- Торр —1/760 высоты ртутного барометра при «стандартном» атмосферном давлении
- Миллиторр или микрон —1000-я 1 Торр
- дюймов ртутного столба (вакуум) —1 / 29,92 раза больше высоты ртутного барометра при «стандартном» атмосферном давлении (принимая атмосферное давление за 0 дюймов ртутного столба)
- Дюйма Hg (прогнозы погоды) —1/29.92 высоты ртутного барометра при «стандартном» атмосферном давлении (без давления 0 дюймов ртутного столба)
- Газ независимый
- от 1 до 760 торр
- Погрешность от 10 до 15%
- Типичная рабочая температура: от 0 ° C до 50 ° C
- Газ независимый
- 0.От 1 до 1000 торр
- Погрешность 1%
- Типичная рабочая температура: от 0 ° C до 40 ° C
- Газ независимый
- Показывает четыре (4) декады ниже полной шкалы (F.
 S.) (т.е. манометр емкости 1000 Торр = от 1000 до 0,1 Торр, манометр емкости 0,1 Торр = от 0,1 до 1e -5 Торр)
S.) (т.е. манометр емкости 1000 Торр = от 1000 до 0,1 Торр, манометр емкости 0,1 Торр = от 0,1 до 1e -5 Торр) - Погрешность от 0,25 до 0,50%
- Версии для окружающей среды или с подогревом
- Типичная рабочая температура: от 0 ° C до 40 ° C
- Зависит от газа
- 1e -3 до 760 торр или 1e -3 до 1 торр
- Обычно пассивный (требуется контроллер)
- Погрешность 50% выше 10 Торр, 15% ниже 10 Торр
- Постоянный ток, переменная температура
- Типичная рабочая температура: от 0 ° C до 100 ° C
- Зависит от газа
- 1e -4 от до 1000 торр
- Точность 50% выше 10 Торр, точность 10% ниже 10 Торр
- Постоянная температура, переменный ток
- Типичная рабочая температура: от 0 ° C до 40 ° C
- Зависит от газа
- 1e -4 от до 1000 торр
- Точность 5% выше 10 Торр, точность 10% ниже 10 Торр
- Постоянная температура, переменная температура
- Типичная рабочая температура: от 0 ° C до 40 ° C
- Зависит от газа
- 1e -9 до 1e -4 Торр (B-A) или 1e -11 до 1e -4 Торр (Nude UHV)
- 30% точность
- Типичная рабочая температура: от 0 ° C до 40 ° C
- Зависит от газа
- 1e -10 до 1e -2 Торр
- 30% точность
- Типичная рабочая температура: от 0 ° C до 55 ° C
частицы твердых тел, жидкости и газы имеют кинетическую энергию (KE).
В твердых телах частицы колеблются с кинетическая энергия, но не может перемещаться в другое положение, но в газах и В жидкости частицы свободно перемещаются с места на место с кинетической энергией.
Частицы также имеют энергии в своих потенциальных хранилищах энергии из-за их позиций — движение от их кинетической энергии держит их разделенными, поскольку оно противостоит силы, притягивающие частицы вместе.
У частиц в газах больше всего потенциальная энергия, потому что они находятся дальше всего друг от друга.
В порядке потенциальной энергии: газы >> жидкости> твердые вещества
Помните, что на среднее между жидкими частицами, но практически не между частицами твердый.
Следовательно, внутренняя энергия системы сохраняется частицами (атомами, ионами, молекулами) из-за их кинетической энергии и интервал-положение.
При нагревании системы энергия переносятся на частицы, например, они быстрее движутся в газах и жидкостях (увеличение KE движения от одного места к другому) или частицы колеблются сильнее в твердом теле (увеличение KE колебаний), поэтому внутренняя энергия увеличивается при нагревании материала .
Здесь за счет повышения n температуры увеличение накопителя тепловой энергии фактически является увеличением Запас кинетической энергии частиц .
Это поглощение тепла, т.е. увеличение внутренняя энергия может вызвать повышение температуры ИЛИ изменение состояния например плавление или кипение, если частицы получают достаточно тепла энергия.
Удаление тепла уменьшает внутреннее энергии, поэтому материал охлаждается до более низкой температуры ИЛИ претерпевает изменение государства например конденсация или замерзание.
Размер сдачи зависит от модели подводимая энергия , масса задействованного вещества и удельных теплоемкость (что зависит от характера материала).
См. Удельная теплоемкость: как ее определить, использование данных, расчеты и накопители тепловой энергии
А также передача тепловой энергии посредством проводимость, конвекция и излучение, изменения состояния, такие как испарение и конденсация также включает передачу тепловой энергии, и модель частиц может быть использована для объясните им.
НА ОТОПЛЕНИЕ — добавление тепловой кинетической энергии, увеличение внутренней энергии
При нагревании твердого тела колебательная кинетическая энергия частиц увеличивается до тех пор, пока у них не будет достаточно KE для ослабить межчастичные связи, чтобы позволить плавиться , и частицы остаются свободными перемещаться в жидком состоянии.
С дополнительным обогревом выше При температуре плавления частицы приобретают большую кинетическую энергию, а связи между частицами еще больше ослабляются, так что частицы на поверхности с самым высоким KE могут покидает поверхность ( испаряется, ) или испаряется в газообразное состояние в объеме жидкости (пузыри!) при температуре кипения .
График ниже показывает, как распределение кинетической энергии и скорости частиц изменяется при изменении температуры — при увеличении температура, средняя скорость и кинетическая энергия частиц увеличивается на .
Обратите внимание, что случайное движение и столкновения частицы создают широкий диапазон скоростей / кинетических энергий.
При повышении температуры большее количество частиц большая кинетическая энергия и большая скорость, , но только самые высокие скорость / кинетическая энергия частицы могут вылетать с поверхности (только крайний правый участок графиков кривых)
Ниже модель испарения частиц .
О ОХЛАЖДЕНИИ — удаление тепловой кинетической энергии — уменьшение внутренней энергии
Если охладить вещество, обратное бывает например охладить газ, чтобы межчастичные связи приносили частицы вместе конденсироваться и образовывать жидкость.
Дальнейшее охлаждение снижает KE жидкие частицы, чтобы при понижении температуры до точки замерзания точки, межчастичные силы достаточны, чтобы «забить» частицы вместе, чтобы сформировать твердое тело.
Все эти изменения физического состояния обратимый за счет добавления или удаления тепловой энергии, новых веществ не образуется ( НЕ химическое изменение ) и все масса сохраняется . Вы начинаете с то, чем вы закончите, и все первоначальные свойства сохраняются.
Единственная разница между состояниями вещества — это то, как расположены частицы (как описано в секция 1.над).
Обратите внимание, что в замкнутая система, масса сохраняется в системе, состояние которой изменяется.
Если растопить 100 г льда, получится 100 г воды!
Однако даже при сохранении массы вы может получить изменение объема, кроме воды, при той же массе жидкости занимают немного больший объем, а газы занимают значительно больший объем, чем жидкая или твердая форма.
Лед необычен, чем твердый лед. кристаллы менее плотные, чем вода, поэтому лед плавает!
Энергия, необходимая для изменения физического состояния вещество при постоянной температуре называется скрытой теплотой.
Существует два значения скрытой теплоты:
Историческое любопытство — скрытое тепло («скрытое» тепло), которое было необъяснимо до тех пор, пока теория частиц материи была разработана и понятна межчастичная связь.
Изменения состояния можно представить в виде графики температура — время.
Кривая отопления — повышение температуры за счет добавления тепловой энергии, увеличивая внутренняя энергия системы.
Кривая охлаждения — снижение температуры за счет отвода тепловой энергии, уменьшая внутренняя энергия системы.
НО, графики не простые «кривые», есть горизонтальные участки, которые необходимо пояснить с использованием концепции скрытая теплота.
Когда твердое тело нагревается от твердого состояние в газообразное состояние и измеренная температура системы непрерывно, на графике есть два горизонтальных участка, где температура не повышается, несмотря на постоянный подвод тепловой энергии (постоянный нагрев). Типичные результаты показаны на кривой нагрева . график ниже.
Этот называется КРИВАЯ НАГРЕВА
По мере того, как вы нагреваете вещество, вы увеличиваете внутреннюю энергию . НО температура остается постоянной при изменении состояния плавления. при температуре Tm и кипения при температуре Tb (см. диаграмму выше).
Это потому, что вся лишняя («скрытая») энергия поглощается нагрев при этих двух температурах (так называемая скрытая теплота изменения состояния), идет на ослабление межчастичного силы (межмолекулярные связи).
Прирост тепловой энергии в этой точке равен тепловая энергия поглощен необходимо уменьшить межчастичные силы при плавлении или кипении — скрытая теплота .
При изменении состояния температура остается постоянный, пока все скрытое тепло не будет поглощено и состояние не изменится завершена, поэтому повышения температуры не произойдет.
Между «горизонтальным» изменением состояния разделах графика, вы можете видеть, что подводимая энергия увеличивает кинетическая энергия частиц и повышение температуры вещества, как вы ожидаете, поскольку внутренняя энергия увеличивается.
Для этих изменений состояния у вас есть добавление скрытая теплота плавления при температуре Tm и добавке скрытая теплота кипения при температуре Tb .
Схема, включающая коричневые полустрелы показывает, что происходит с запасами энергии на кривой нагрева.
Охлаждая вещество, вы уменьшаете внутреннюю энергию . НО температура остается постоянной при изменении состояния уплотнение при температуре Tc и замерзания при температуре Tf (см. диаграмму ниже).
Аналогично, когда газ охлаждается от газообразное состояние в твердое состояние и температура системы измеряется непрерывно, на графике есть два горизонтальных участка где температура не падает, несмотря на постоянное удаление тепловая энергия (непрерывное охлаждение).Типичные результаты показаны на графике кривой охлаждения ниже.
Этот называется КРИВАЯ ОХЛАЖДЕНИЯ
По мере того, как вы охлаждаете вещество, вы уменьшаете внутреннюю энергию. НО температура остается постоянной при изменении состояния конденсации. при температуре Tc и замерзание / затвердевание при температуре Tf.
Это потому, что все лишнее («скрыто») тепловой энергии, отводимой при охлаждении при этих температурах ( скрытая теплота изменения состояния), снижает KE и потенциальная энергия частиц.
Потеря тепла компенсируется повышенной межмолекулярной силой притяжение, выделяющее тепловую энергию.
При изменении состояния температура остается постоянным, пока не будет снято все скрытое тепло и состояние не изменится завершена, поэтому падение температуры не произойдет.
Между «горизонтальными» участками изменения состояния На графике видно, что «отвод» энергии снижает кинетическую энергию частицы, понижающие температуру вещества.
Для этих изменений состояния у вас есть удаление скрытая теплота конденсации при температуре Tc и отвода скрытая теплота замерзания при температуре Tf .
Схема, включающая синие полустрелки показывает, что происходит с накопителями энергии на кривой охлаждения.
Когда материалы разные температуры находятся в контакте друг с другом, будет внутренняя энергия передача тепловой энергии от более горячего материала к более холодный материал.
(1) Использование льда для охлаждения напитка
Когда вы добавляете лед в напиток, чтобы охладить его, происходит изменение внутренней энергии с участием скрытой теплоты таяние .
Лед имеет более низкую температуру, чем жидкий напиток.
Жидкие частицы с более высокой энергией передают кинетическую энергию льду , увеличивая его внутреннюю энергию .
Достаточная тепловая энергия — скрытая теплота таяния , поглощается льдом, чтобы растопить его.
Энергия нужна, чтобы ослабить межмолекулярные силы между молекулами воды во льду достаточно, чтобы вызвать плавление — когда частицы имеют достаточно энергии, чтобы освободиться от сил притяжения между частицами.
Лед нагревается, а напиток остывает вниз — внутренняя передача тепловой энергии!
(2) Холодильник — морозильная камера
В холодильной системе электрическая насос используется для сжатия газа до сжижения — это насос-компрессор вызывает конденсацию и высвобождает скрытое тепло конденсация.
Затем жидкости дают испариться, поглощая его скрытого тепла испарения .
Эта тепловая внутренняя энергия берется из содержимого холодильника с морозильной камерой .
Внутренняя энергия морозильной камеры содержание уменьшается, понижая температуру пищи.
Ты чувствуешь теплый воздух позади ваш холодильник, это из-за выделения скрытой теплоты конденсации.
Удельная скрытая теплота вещество — количество энергии, необходимое для изменения 1 кг материала из одного состояния в другое без изменения температуры.
(a) При нагревании материала для изменение состояния e.грамм. плавления или кипения, удельная скрытая теплота должна быть добавлен.
(b) При охлаждении материала до изменение состояния например конденсации или замерзания, удельная скрытая теплота должна быть удаленным (освобожденным) из системы.
Значения удельной скрытой теплоты различаются от вещества к веществу из-за разных значений межчастичные силы (межмолекулярная связь), а также изменение состояния сам для конкретного вещества (твердое <=> жидкое ИЛИ жидкое <=> газ).
Вообще говоря, скрытая теплота кипение / конденсация численно намного больше, чем скрытая теплота плавление / замораживание.
Скрытое тепло для изменения состояния твердое тело <=> жидкость называется удельной скрытой теплотой плавления (для плавления или замораживания).
Скрытое тепло для изменения состояния жидкость <=> газ называется удельной скрытой теплотой испарение (для конденсации, испарения или кипячения)
Конкретный теплоемкость рассматривается на отдельной странице
Для выработки необходимой энергии или выпущен для изменения состояния массы m вещества следующее формула применяется
передача тепловой энергии = масса x удельная скрытая теплоемкость
E (Дж) = m (кг) x L (Дж / кг)
E =
млВам также может понадобиться то уравнение удельной теплоемкости
e нервный перенесенная = масса x удельная теплоемкость x изменение температуры
E (Дж) = м (кг) x SHC (Дж / кг o C) x ∆T ( o C)
SHC часто обозначается как c, ∆T часто обозначается как ∆θ
, так что уравнение просто E = mc∆T или E = mc∆θ
Немного неприятно, что одинаковые обозначения не используются единообразно, но привыкните к этому!
Вам также может понадобиться электричество уравнения мощности P (W) = I (A) x V (V) или P (Вт) = E (Дж) / т (с)
Некоторые примеры расчет скрытой теплоты
Q1 Скрытая теплота плавления воды 334000 Дж / кг (334 кДж / кг).
Q2 Удельная скрытая теплота испарение воды составляет 2 265 000 Дж / кг (2265 кДж / кг).
Сколько энергии нужно для кипячения 250 г воды при 100 o ° C?
250 г = 250/1000 = 0,25 кг
E = mL = 0,25 x 2 265 000 = 566 250 Дж = 566 кДж или 5.66 x 10 5 J (3 SF)
–
Q3 Для алюминия скрытое тепло плавления составляет 397000 Дж / кг, а скрытая теплота парообразования составляет 11 400 000 Дж / кг.
Сколько энергии нужно для полностью испаряется 1,5 кг алюминия
Для плавления: E = mL = 1.5 х 397 000 = 595500 Дж, 595,5 кДж
Для испарения: E = mL = 1,5 x 11 400000 = 17100000 Дж, 17100 кДж
Общая необходимая энергия = 595,5 + 17 100 = 17700 кДж или 1,77 х 10 7 J (3 SF)
–
Q4 Какую массу льда можно растопить? на 1 миллион Дж тепловой энергии?
Скрытая теплота плавления воды 334 000 Дж / кг
E = mL, перестановка дает m = E / L
м = 1 000 000/334 000 = 3.0 кг
–
Q5 В эксперименте 5 г твердого Для плавления золота потребовалось 322 Дж тепловой энергии при 1063 o C.
Рассчитайте скрытую теплоту плавления золота.
5 г = 5/1000 = 0,005 кг
E = mL, перестановка дает L = E / m
L = 322/0.005 = 64400 Дж / кг
–
Примеры Q6 и Q7 немного сложнее работать, так что посмотрите, последуете ли вы аргументам!
Q6 (а) Сколько энергия необходима для преобразования 500 г льда при 0 o C в пар при 100 o ° C?
Вам нужны еще три штуки информации для завершения расчета и трех промежуточные расчеты, чтобы прийти к окончательному ответу.
SHC воды 4180 Дж / кг o C, скрытая теплота плавления воды (льда) составляет 334 000 Дж / кг, а скрытая теплота испарения воды 2 265 000 Дж / кг и 550 г = 0,50 к.
(i) Энергия , чтобы растопить лед :
E = мл
E = 0,5 x 334 000
E = 167000 Дж
(ii) энергия для подъема температура воды ° C от 0 o C до 100 o C:
(iii) энергия кипения вода при 100 o C:
(iv) Наконец, добавьте все из (i) к (iii) вместе.
(б) Если вы следили повышение температуры со временем по мере нагрева льда, эскиз график температуры-времени, который вы можете ожидать, и объясните его особенности.
Изначально лед тает при 0 o C и смесь льда / воды остается при постоянной температуре, пока скрытая теплота плавления поглощается.
Затем жидкая вода устойчиво Температура повышается до тех пор, пока точка кипения не достигнет 100 o C.
Температура воды тогда остается постоянной при температуре 100 o C, поскольку вода выкипает, поглощение скрытой теплоты испарения.
Q7 Глыба льда при -10 o C плавили и далее нагревали до 20 o C.
ПДС льда 2100 Дж / кг o C, SHC воды 4180 Дж / кг 90-109 o C и скрытая теплота плавления воды (льда) 334 000 Дж / кг.
(a) Если 200 000 Дж из ко льду подавалась тепловая энергия, какая была исходная масса льда?
Это включает в себя несколько этапов расчета и какой-то четкой логической мысли!
Пусть м масса лед.
(i) Энергия, необходимая для нагрева лед от -10 o C до 0 o C.
(ii) Энергия, необходимая для плавления лед
(iii) Энергия, необходимая для обогрева вода от 0 o C до 20 o C.
(iv) Общая необходимая энергия
(v) Теперь полная энергия требуется = общая поставленная энергия
(b) Если вы следил за повышением температуры со временем, набросал температуру — график времени, который вы могли бы ожидать и объяснить его особенности.
Изначально твердый лед устойчиво нагревается от -10 o C до температуры плавления достигается при 0 o C.
Температура остается постоянный, поскольку лед тает, поглощая скрытое тепло слияние.
Когда весь лед растает температура воды постоянно повышается до 20 o C поскольку молекулы приобретают кинетическую энергию движения от места к место.
Q8 A 500 Вт Нагревательный элемент используется для нагрева 1,50 кг твердого вещества до тех пор, пока достигает точки плавления, но еще до того, как начинает плавиться.
Если потребуется еще 10,0 минут нагрева, чтобы расплавить все твердое, что такое скрытая теплота сплавление твердого тела?
P (Вт) = E / t (Дж / с)
поставленная энергия = E = P x t = 500 x 10 x 60 = 300 000 Дж
термоядерный синтез со скрытой теплотой = 300 000 / 1.5 = 200 000 Дж / кг
–
Q9
Все частицы имеют массу , и их движение дает им кинетическую энергию и импульс.
Частицы в газе находятся в постоянном случайное движение — случайное направление, различные скорости и кинетические энергии.
Хотя столкновения происходят случайно в любом направлении возникает равнодействующая сила , действующая под прямым углом к любая поверхность .
Давление газа всегда будет, если контейнер не находится под вакуумом, без частиц — без столкновений — нет давление!
Когда быстро движутся частицы газа сталкиваются с поверхностью, их миллионы ударов создают силу, которую мы измерить как давление газа — суммарную силу удара на единицу площади.
Частицы сталкиваются с контейнером поверхность полностью случайна и ударяется под любым углом, НО, эффект чтобы создать чистую силу под прямым углом к поверхности — давление газа!
Более сильные столкновения на поверхность или большее количество столкновений на единицу площади поверхности, тем больше давление, если объем газа остается постоянным.
Если температура поддерживается постоянной и объем увеличился, удары более распространены и реже единицу площади, поэтому давление газа уменьшается.
И наоборот, если газ сжатие в меньший объем при постоянной температуре, число ударов на единицу площади увеличивается, поэтому давление увеличивается.
Если стенки газового баллона являются «гибкими» (например, баллон), объем будет постоянным только тогда, когда внутреннее и внешнее давления равны.
Из измерений объемов и давления газов при постоянном давлении, числовой обратный закон может быть сформулированы — см. график справа.
давление x объем = постоянная (при постоянной температуре)
pV = постоянная
p = давление в паскалях (Па = Н / м 2 ), V = объем (м 3 )
Вы можете подключить два давления и два объема по простому уравнению
p 1 x V 1 = p 2 x V 2
где 1 — оригинал условия, и 2 конечная ситуация, если принудительное изменение p 1 или V 1 .
Примеры простого газа расчеты
(i) Рассмотрим стальной баллон с газом — жесткая ограждающая стена
Когда газ содержится в жестком сосуде вы можете закачать много газа до давления намного выше, чем окружающие атмосферное давление.
Стальные цилиндры используются в промышленности для храним газообразные химикаты, а дома мы использовали баллоны с углеводородом газы для отопления и приготовления пищи.
Эффект от i ncreasing количество газа в баллоне
Чем больше газа вы вдавливаете, тем больше внутреннее давление из-за увеличения количества ударов частиц за единица площади — большая концентрация частиц означает большее воздействие на такая же площадь поверхности.
Для данного баллона объем газа равен постоянным, а давление пропорционально количеству закачанного газа при постоянная температура .
Давление и объем обратно пропорциональны пропорциональны друг другу.
P x V = константа , P = давление в Па (паскалях), V = объем в м 3 .
При постоянной температуре увеличение объем уменьшает давление, потому что столкновения более распространены по та же площадь — меньше столкновений частиц на единицу площади.
При постоянной температуре уменьшение объем увеличивает давление, потому что столкновения более сконцентрированы над та же площадь — больше столкновений частиц на единицу площади.
См. Также P-V-T давление-объем-температура газ законы и расчеты
Если внутреннее и внешнее давление не сбалансирован, это не проблема с прочным цилиндром со стальными стенками!
Эффект увеличения температура газа в баллоне
Если цилиндр нагреть , он расширится немного, но это не компенсирует повышение давления газа, так как газ пытается расшириться.
Если баллон и его содержимое увеличиваются при температуре , то запас тепловой энергии увеличивается по мере того, как частицы приобретают кинетическую энергию.
Это увеличение кинетической запас энергии увеличивает скорость столкновения частиц И силу частицы ударяются о поверхность контейнера, тем самым повышая давление с повышение температуры.
Это довольно опасная ситуация, пожарные сталкиваются при тушении пожара на заводе, где газовые баллоны б / у — высокие температуры и высокое давление, создаваемое в газовых баллонах заставит их сильно взорваться.
(ii) Рассмотрим баллон с газом — гибкая ограждающая стена
Если по бокам газ контейнеры являются «гибкими» (например,грамм. как воздушный шар) объем будет только быть постоянным, когда внутреннее и внешнее давление равны.
Если внешнее давление больше при внутреннем давлении баллон уменьшится в объеме (размере).
Если внутреннее давление больше При внешнем давлении баллон увеличится в объеме (надуется).
Чтобы надуть воздушный шар, в который вы надуваетесь с силой, превышающей атмосферное давление, чтобы создать объем захваченный газ.
Размер воздушного шара определяется количеством воздуха. вы продули и атмосферное давление окружающей среды.
Давление газа в воздушном шаре создает чистую внешнюю силу под прямым углом к поверхность контейнера из-за внутренних ударов частиц газа.
НО, как вы наблюдаете с взорванным воздушный шар, похоже, он не расширяется или сжимается.
Причина в том, что наружный воздух удары частиц по внешней поверхности воздушного шара создают противоположный и равное уравновешивающее давление.
При вдувании воздуха вы увеличиваете внутреннее давление и заставьте воздушный шар расширяться, толкая резиновую оболочку наружу, пока внутреннее и внешнее давление не сравняются при расширении остановится.
Когда вы вдыхаете, вы увеличиваете количество ударов частиц на единицу площади внутренней поверхности для создания большая внешняя действующая сила.
Помните, увеличение объема газа при постоянной температуре понижается давление (pV = постоянное).
Давление, которое вы создаете изначально, когда раздувая воздушный шар, он должен уменьшаться при расширении — меньше ударов частиц на единицу площади.
Если вы выпустите воздух из воздушного шара, или он утечки, меньше ударов частиц на единицу площади и давление снижается, поэтому большее внешнее давление заставляет баллон сокращаться, пока объем не уменьшится, создавая давление, равное внешнее атмосферное давление.
Если баллон надут воздухом нагретый , частицы газа внутри будут увеличивать кинетическую энергию создание большего количества столкновений и более сильных столкновений — увеличение чистой сила, действующая на поверхность.
Следовательно, давление увеличивается и воздушный шар расширяется.
НО, расширение распространяет столкновения (что снижает давление — меньше силы на единицу площади), поэтому баллон расширяется только до тех пор, пока внутреннее давление не сравняется с внешним давление более холодного воздуха.
Когда воздушный шар остынет, он уменьшение размера, менее сильные столкновения частиц, воздушный шар сжимается до опять же, внутреннее и внешнее давления равны.
Когда гелиевые метеорологические шары выпущенные, они быстро поднимаются в атмосфере и сильно расширяются потому что атмосферное давление значительно уменьшается с увеличением высота над поверхностью земли.
По мере уменьшения внешнего давления (меньше ударов частиц на единицу площади) внутреннее давление больше (больше ударов), и поэтому большее количество внутренних ударов на единицу площади приводит к увеличению объема газ в баллоне увеличится.
Гелиевый шар продолжит полет. расширяться до тех пор, пока внешнее давление меньше внутреннего.
Он перестанет расширяться, когда внутренний давление в баллоне падает до уровня внешнего давления.
Однако, поскольку он заполнен плотный гелий, он будет продолжать подниматься и подниматься!
(iii) Те же аргументы применимы к выдуванию покрышку велосипеда, автомобильную шину или что-нибудь еще!
Любое увеличение внешнего давление из насосной системы позволит расширить шину, если она превышает внутреннее давление внутри шины — в противном случае больше ничего инфляция!
Когда вы запечатываете конец газа шприцем (как в химии) рукой и нажмите плунжер внутрь.
Вы можете сжать воздух, чтобы создать большее давление газа чем внешнее атмосферное давление. НО, хотя давление изначально не сбалансирован, так как в случае надувания шара это ваш дополнительный мышечная сила, которая помогает создать уравновешивающую силу.
внутреннее давление в шприце = атмосферное давление + давление от мышечной силы
–
Увеличение запаса энергии газа путем сжатия
Когда вы накачиваете воздух в велосипедную шину так энергично, как вы можете, вы можете обнаружить повышение температуры, особенно возле точки подключения насоса. Итак, почему увеличение температура газа?
Когда вы сжимаете газ, применяя механическая сила вы делаете работу сжатия на газе .
Эта работа по сжатию газа увеличивает внутреннюю энергию и увеличивает температуру — увеличивает накопитель тепловой энергии — увеличивается запас кинетической энергии.
Вы должны работать на газе потому что когда вы сжимаете воздух в насосе, давление повышается по мере того, как сила удара частиц действует против вас, поэтому вы должны работать против этой увеличенной силы на единицу площади (давления), чтобы воздух попадал в шина.
Выполняя работу с газом таким образом увеличение внутреннего запаса энергии газа заканчивается как повышенная кинетическая энергия частиц, которая вызывает повышение температуры подъем воздух, шина и насос.
Этот эффект используется в холодильниках. где газообразный хладагент сжимается для высвобождения энергии в замкнутом система — эта тепловая энергия получается из жидкого хладагента испаряется за счет поглощения скрытой теплоты испарения из интерьер холодильника с морозильной камерой.
Если сжать газ, уменьшится его объем, вы увеличиваете его внутреннюю энергию, увеличивая средний кинетическая энергия частиц и газ нагревается с увеличением его температура.
Если вы расширите газ, увеличивая его объем, вы уменьшаете его внутреннюю энергию, уменьшая средний кинетическая энергия частиц, газ охлаждается, когда температура уменьшено.
Увеличение запаса энергии газа путем нагрева
Повышение температуры газа увеличивает запас кинетической энергии.
Повышение температуры увеличивает средняя скорость частиц и их кинетическая энергия.
На самом деле температура газа равна пропорциональна средней кинетической энергии частиц.
Это означает нагрев газа в герметичном контейнера больше ударов частиц и более сильных ударов по площадь на единицу площади.
Следовательно, нагрев газа при постоянной объем увеличивает давление газа.
И наоборот, если у вас холодный и запечатанный баллон с газом, давление снижается.
Подробнее о газы и многое другое газовые расчеты
Конденсация происходит, когда газ / пар достаточно охлаждается до достаточно низкой температуры, чтобы позволить силы притяжения должны быть достаточно сильными, чтобы притягивать частицы вместе как жидкость. Это может произойти только в том случае, если кинетическая энергия частиц мала. достаточно (чем ниже температура, тем меньше кинетическая энергия).
Водяной пар в воздухе зимой конденсируется на холодных поверхностях, например, оконный конденсат, невидимый пар из кипящего чайника конденсируется в облака крошечных капли воды, что технически не является паром! и капли дождя образуются в более прохладные области атмосферы.
Факторы, влияющие на скорость конденсация
Чем холоднее газ, тем быстрее он конденсируется — более низшие частицы КЭ могут притягиваться вместе.
Чем ниже температура поверхность, с которой контактирует газ.
Нижний поток воздуха над поверхности, это поддерживает концентрацию конденсирующегося газа на уровне возможный.
Когда пар / газ конденсируется, скрытая теплота испарения должна быть удалена для охлаждения частиц достаточно для образования конденсата.
Из-за этого ошпаривание пар хуже, чем ошпариться кипятком.
Оба предполагают передачу теплового энергия за счет теплоемкости жидкой воды.
НО, водяной пар должен быть первым сконденсированный, поэтому изначально вас ошпаривает выброс скрытого теплота испарения = «скрытая теплота конденсации».
Испарение — это когда частицы жидкости с самой высокой кинетической энергией вылетают с поверхности, т. е. могут преодолевать силы притяжения основной массы частиц.Чем больше KE частицы жидкой поверхности, тем больше шанс вырваться и стать частица газа. Испарение может происходить при любой температуре от температура плавления и кипения вещества. Как высшие частицы КЭ улетучивается, оставляя более медленные нижние частицы KE, большая часть жидкости будет прохладно, поэтому испарение жидкости сопровождается охлаждающим эффектом. В охлаждающий эффект потоотделения обусловлен испарением воды с кожи.
Факторы, влияющие на скорость испарение
Чем выше жидкость температуры, тем быстрее скорость испарения — больше частиц с достаточным кинетическая энергия, уходящая с поверхности (график выше).
Напоминание о модели частиц испарения
Чем больше площадь поверхности, чем быстрее испарение, тем больше площадь, больше вероятность испарения.
Чем больше воздушный поток над чем выше скорость испарения — воздух может стать насыщенным парами жидкости, поэтому его легче заменить, если уже испаренная жидкость уносится воздухом, протекающим по поверхности.
Эффективная сушка белья — это хороший пример этих трех факторов — вам нужен теплый солнечный день (выше температура), стирка хорошо разложенные по линии (площадь поверхности) и приятный ветерок ( выпаренная вода прочь)!
Когда вода испаряет скрытое тепло испарения поглощается молекулами воды, обеспечивая охлаждение эффект.
- Протокол эксплуатации системы инертного газа
- Журнал технического обслуживания системы инертного газа (работающей)
- Протокол технического обслуживания системы инертного газа (стыковка)
- Прием / отказ от топлива в споре о качестве
Прием мазута для использования на судне требует тщательного рассмотрения, поскольку топливо низкого качества может вызвать проблемы в работе топливной системы главного двигателя судна, такие как засорение очистителя или фильтра, образование задиров или отказ топливного насоса, серьезный износ гильзы цилиндра, заклинивание топливной форсунки, коррозия седла выпускного клапана. или продувка, и колесо турбины турбонагнетателя засорено.Выше приведен лишь краткий список потенциальных проблем. Старший механик судна должен руководствоваться здравым смыслом, прежде чем принимать решение о приеме или отказе от бункерного топлива …… - Руководство по бункеровке
Бункеровка мазута — это критически важная операция на борту судов, которая требует безопасной загрузки нефти в топливные баки, не вызывая переполнения нефти. Поскольку стоимость бункеров составляет 50% от общих эксплуатационных расходов судов, судовладельцам необходимо искать способы постоянного мониторинга и контроля этих огромных расходов.Обычно физическая коммерческая передача бункеров осуществляется за тысячи миль от офисов договаривающихся сторон, при этом ни покупатель, ни продавец не присутствуют во время фактических бункеровочных операций. …… - Общие бункерные термины и соответствующее руководство
Бункеровка судов обычно применяется для хранения нефтепродуктов в специальных резервуарах для силовой установки главного двигателя судна и выработки электроэнергии в море. Бункеровка — это основная часть расходов судовладельцев при ведении бизнеса.Осмотрительному судовладельцу / оператору нужен план бункеровки, позволяющий приобретать бункеры по лучшей цене в количествах, достаточных для безопасного плавания, но также позволяющий перевозить максимальный груз. Заправка судов осуществляется во всех крупных морских портах. …….. - Руководство по бункеровке судов — планирование, подготовка, проверки и подтверждение безопасности
Следует внедрить контрольные списки бункеровок, чтобы снизить риск небрежности и других операционных ошибок.Они должны выполняться после консультации с главным инженером, поскольку он обычно является ответственным за бункеровку. Перед бункеровкой, как правило, младший инженер проводит зондирование бункерных цистерн и подсчитывает объем мазута в каждом топливном баке на судне. Затем составляется план бункеровки для распределения подлежащего приему мазута. - Организация бункеровки и факторы безопасности на борту
Когда возникают споры по поводу количества и качества переданного, расследования после доставки обычно не дают результатов, если судовой персонал принимающего судна не соответствует требованиям и / или полностью проинформирован и обучен.Протесты, судебные издержки, время руководства, потеря репутации, стресс — все это увеличивает расходы, и обычно ни одна из сторон не делает однозначных выводов о том, что произошло на борту … - Процедура безопасной бункеровки и подробное руководство для судов
Бункеровка может осуществляться на море, на якоре или на берегу. Его можно перекачивать с автоцистерны, бункеровочной баржи или другого танкера или судна. Независимо от поставщика, выполняемые процедуры аналогичны. Бункеровку следует рассматривать как операцию с высоким риском, когда ошибки могут привести к загрязнению, высоким финансовым штрафам или даже тюремному заключению…… - Как вести учет бункеровок?
Последствия нехватки бункеров или бункеров, не соответствующих спецификациям, могут быть очень серьезными. Бункерное снабжение более низкого качества может привести к отказу двигателя корабля, потерям времени и дополнительным расходам на заправку. Во многих частях мира жадные поставщики бункеров обманывают, чтобы поставлять меньше. И то, и другое не только увеличивает финансовую нагрузку на судовладельца, но и наносит ущерб деловой репутации.Поэтому для безопасной бункеровки необходимо сделать некоторые важные соображения. - Меры предосторожности перед переливом мазута в резервуары для хранения
Топливные масла загружаются через заправочные патрубки палубы, на которых есть пробоотборные патрубки, позволяющие отбирать пробы топлива по мере его поступления на борт. HFO помещается в резервуары для хранения, снабженные нагревательными змеевиками. При подготовке к использованию HFO перекачивается в отстойники мазута через перекачивающие насосы FO, которые оснащены сетчатым фильтром на всасывании.Трубопроводы устроены так, что насосы могут перекачивать топливо между резервуарами для хранения и соединениями палубы для разгрузки. Отстойные баки используются для осаждения на дно валовой воды и твердых частиц. …… - Обработка отработанного масла и нефтесодержащих льяльных вод
Все современные типы грузовых судов в настоящее время в основном оснащены инсинераторами для переработки отработанного масла, льяльных вод и шламов, образующихся в машинных помещениях судов, а также устройствами для выгрузки за борт при концентрации менее 15 ppm. Однако, если такое удаление на борту является неправильным или невозможным, особенно когда судно проходит транзитом через специальный район, все отходы следует вынести на берег для захоронения на береговом приемном сооружении…… - Порядок действий для нефтяных танкеров и порядок ведения учета
Танкеры — это специализированные суда, которые включают в себя танкеры для сырой нефти, нефтепродуктов, химикатов, СПГ и другие типы танкеров. Танкеры проводят значительное время в балласте, учитывая типичный односторонний характер основных сделок. Танкеры саморазгружаются, и большинство из них оснащено серией насосов, которые позволяют быстро выполнять оборот в порту … - Обогрев резервуара для хранения мазута
Судовые бункерные цистерны для мазута и цистерны для отработанного масла должны иметь какую-либо форму подогрева цистерн.Обычно нагрев осуществляется паром, вырабатываемым масляным котлом и проходящим через змеевики внутри масляного бака. Другие способы нагрева топливных баков — использование термомасла. В нем также используется котел, работающий на жидком топливе, который нагревает термомасло, которое циркулирует через змеевики внутри резервуара с помощью насоса. Регулирование и мониторинг температуры могут быть автоматическими и саморегулирующимися, но обычно они выполняются путем проверки температуры резервуара и соответствующей ручной регулировки нагрева … - Контроль вязкости мазута
Контроль вязкости топлива — это метод контроля вязкости и температуры мазута (FO) при активном пожаре в дизельных двигателях моторных судов и генераторах нефтяных энергетических установок.Вязкость мазута сильно зависит от температуры; чем выше температура, тем ниже вязкость …… - Руководство по безопасности танкеров — система инертного газа
Судам, перевозящим грузы, выделяющие пары углеводородов, требуется инертизирующий раствор, чтобы исключить риск взрыва и пожара в грузовых танках (танкеры для сырой нефти, танкеры-химовозы, танкеры-продуктовозы, газовозы и т. Д.). Система инертного газа используется для поддержания содержания кислорода ниже 8%, стандарта, установленного Международной морской организацией (IMO)…… - Инструкция по безопасности танкеров — процедура дегазации
Самый безопасный способ дегазации масляного бака, оснащенного системой инертного газа, — это использовать вентилятор и удалить воздух из бака. Перед входом необходимо использовать измеритель O2, а резервуар также необходимо проверить взрывомером. Эти счетчики также необходимо использовать в резервуаре. На эскизе схематично показан взрывной прибор ….. - Меры предосторожности перед входом в зону замерзания — пункты проверки при эксплуатации нефтяных танкеров
Океанская вода замерзает так же, как и пресная, но при более низких температурах.Пресная вода замерзает при температуре 32 градуса по Фаренгейту, но морская вода замерзает при температуре около 28,4 градуса по Фаренгейту из-за содержащейся в ней соли. Из-за наличия множества враждебных условий любое торговое судно при заходе в промерзающую акваторию моря сталкивается со значительными проблемами, касающимися безопасности и надежности судоходства. Капитан судна должен убедиться, что были приняты следующие меры для предотвращения повреждения Судна, Машин, Трубопроводов и Оборудования до входа в районы с условиями замерзания…… - Руководство по безопасности танкеров — как предотвратить разлив нефти
Существует неотъемлемый риск разлива нефти при перевалке нефтеналивных грузов на борту нефтяного танкера. Однако хорошие профилактические инициативы могут иметь большое значение для снижения риска загрязнения нефтью с судов. В случае любого разлива нефти с судна необходимо обеспечить наличие эффективных мер готовности для обеспечения своевременного и скоординированного реагирования для ограничения неблагоприятных последствий инцидентов загрязнения, связанных с нефтью и опасными и ядовитыми веществами (HNS).Ниже мы кратко изложили некоторые основные принципы безопасной обработки нефтяных грузов … - Руководство по безопасности танкеров — процедуры очистки резервуаров
Очистка танков — это процесс удаления паров углеводородов, жидкостей или остатков из грузовых танков на борту танкера. Очистка резервуара может потребоваться по одной или нескольким из следующих причин: Для перевозки чистого балласта, безгазовых цистерн для внутреннего осмотра, ремонта или перед заходом в сухой док. Также для удаления отложений с обшивки бака. - Бюветная процедура
Насосное отделение на борту нефтяного танкера содержит наибольшую концентрацию грузовых трубопроводов среди всех помещений на судне, и утечка летучих продуктов из любой части этой системы может привести к быстрому образованию воспламеняющейся или токсичной атмосферы … - Инспекция насосного отделения танкеров
Правильное использование и настройка систем вентиляции насосных отделений необходимы для обеспечения того, чтобы насосные отделения оставались свободными от взрывоопасной или токсичной атмосферы.Системные вентиляторы неизменно настроены на всасывание из-под нижних плит пола, то есть из зоны трюма. Это обеспечивает полную и правильную циркуляцию всего воздуха в насосном отделении для поддержания безопасной атмосферы … - Мойка танкеров сырой нефтью
Мойка сырой нефтью (C.O.W.) — это система, при которой нефтяные танки на танкере очищаются между рейсами не водой, а сырой нефтью — самим грузом. Растворитель сырой нефти делает процесс очистки намного более эффективным, чем при использовании воды.Однако такой метод мойки грузовых танков сопряжен со многими опасностями, и необходимо тщательно продумать его для безопасного планирования и выполнения. …… - Метод предотвращения загрязнения маслом
Любое неправильное использование мазута может привести к серьезным претензиям и поставить под угрозу безопасность судна. Международное руководство по безопасности нефтяных танкеров и терминалов (ISGOTT) содержит рекомендации по безопасной перевозке и обработке нефтяных грузов, которые рассматриваются как фундаментальная часть общей безопасности танкеров. - Общие меры предосторожности для танкеров
Следует избегать навигации во время грозы, насколько это практически возможно, путем изменения курса во время выполнения грузовых операций, которые могут привести к выбросу легковоспламеняющихся паров. Если невозможно избежать прохождения грозы, все открытые люки грузовых нефтяных танков должны быть закрыты до тех пор, пока судно не пройдет через грозу. Клапаны в главных вентиляционных линиях могут быть временно заблокированы в заблокированном положении, но должны быть открыты сразу после прохождения через них. гроза…….. - Оборудование и механизмы танкера
Главный инженер и старший помощник капитана несут совместную ответственность за осмотр и техническое обслуживание следующего оборудования и механизмов для перевалки нефти перед заходом в порт. Главный инженер должен подготовить и поддерживать в рабочем состоянии руководства по оборудованию машин и оборудования, включая критически важные компоненты, относящиеся к грузовым операциям, включая процедуры их аварийной эксплуатации. Все предметы должны быть в хорошем рабочем состоянии. - Как обеспечить безопасную рабочую атмосферу на борту?
Контрольный список по безопасности на судне — Контрольный список по безопасности и содержанию …
Давление газа
10.2 Давление газа
Цель обучения
На макроскопическом уровне полное физическое описание образца газа требует четырех величин: температура (выраженная в кельвинах), объем, (выраженная в литрах), величина, (выраженная в молях) и давление. (в атмосферах). Как мы объясняем в этом разделе и в разделе 10.3 «Взаимосвязь между давлением, температурой, объемом и количеством», эти переменные не являются независимыми. Если нам известны значения любых , трех, из этих величин, мы можем вычислить четвертое и таким образом получить полное физическое описание газа. Температура, объем и количество обсуждались в предыдущих главах. Теперь обсудим давление и его единицы измерения.
Ед. Давления
Давления
Любой объект, будь то ваш компьютер, человек или образец газа, воздействует на любую поверхность, с которой соприкасается.Например, воздух в воздушном шаре оказывает усилие на внутреннюю поверхность воздушного шара, а жидкость, впрыскиваемая в форму, оказывает усилие на внутреннюю поверхность формы, точно так же, как стул прикладывает силу к полу из-за его масса и влияние гравитации. Если воздух в воздушном шаре нагревается, повышенная кинетическая энергия газа в конечном итоге приводит к разрыву воздушного шара из-за повышенного давления ( P ). Величина силы (F), приложенная к данной области (A) поверхности: P = F / A.газа, сила ( F ) на единицу площади ( A ) поверхности:
Давление зависит от и — приложенной силы, и — размера области, к которой приложена сила. Из уравнения 10.1 мы знаем, что приложение той же силы к меньшей площади создает более высокое давление. Например, когда мы используем шланг для мытья автомобиля, мы можем увеличить напор воды, уменьшив размер отверстия шланга большим пальцем.
Единицы давления являются производными от единиц измерения силы и площади.В английской системе единицы измерения силы — фунты, а единицы площади — квадратные дюймы, поэтому мы часто видим давление, выраженное в фунтах на квадратный дюйм (фунт / дюйм 2 или фунт / кв. Дюйм), особенно среди инженеров. Однако для научных измерений силы в системе СИ предпочтительны. Единица СИ для давления, производная от единиц СИ для силы (ньютонов) и площади (квадратные метры), — это ньютон на квадратный метр (Н / м 2 ), который называется паскаль (Па). давление.Паскаль — это ньютоны на квадратный метр: Н / м2., По французскому математику Блезу Паскалю (1623–1662):
Уравнение 10.2
1 Па = 1 Н / м 2Чтобы преобразовать фунты на квадратный дюйм в паскали, умножьте фунты на квадратный дюйм на 6894,757 [1 Па = 1 фунт на квадратный дюйм (6894,757)].
Блез Паскаль (1623–1662)
В дополнение к своим математическим талантам (он изобрел современную теорию вероятностей), Паскаль проводил исследования в области физики, а также был писателем и религиозным философом. Его достижения включают изобретение первого шприца и первого цифрового калькулятора, а также разработку принципа передачи гидравлического давления, который сейчас используется в тормозных системах и гидравлических подъемниках.
Его достижения включают изобретение первого шприца и первого цифрового калькулятора, а также разработку принципа передачи гидравлического давления, который сейчас используется в тормозных системах и гидравлических подъемниках.
Пример 2
Предположим, что книга в мягкой обложке имеет массу 2,00 кг, длину 27,0 см, ширину 21,0 см и толщину 4,5 см, какое давление она оказывает на поверхность, если оно составляет
Дано: Масса и габариты объекта
Запрошено: давление
Стратегия:
A Вычислите силу, прилагаемую к книге, а затем вычислите площадь, которая соприкасается с поверхностью.
B Подставьте эти два значения в уравнение 10. 1, чтобы найти давление, оказываемое на поверхность в каждой ориентации.
1, чтобы найти давление, оказываемое на поверхность в каждой ориентации.
Решение:
Сила, прикладываемая книгой, или не зависит от ее ориентации. Вспомните из главы 5 «Изменения энергии в химических реакциях», что сила, прилагаемая объектом, равна F = ma , где m — это его масса, а a — его ускорение.В гравитационном поле Земли ускорение происходит за счет силы тяжести (9,8067 м / с 2 у поверхности Земли). Таким образом, в единицах СИ сила книги равна
. F = мА = (2,00 кг) (9,8067 м / с 2 ) = 19,6 (кг · м) / с 2 = 19,6 НУпражнение
Какое давление оказывает на пол школьник весом 60,0 кг
Ответы:
Атмосферное давление
Наша атмосфера действует так же, как мы оказываем давление на поверхность под действием силы тяжести. Мы живем на дне океана газов, который становится все менее плотным с увеличением высоты.Приблизительно 99% массы атмосферы находится в пределах 30 км от поверхности Земли, а половина ее находится в пределах первых 5,5 км (рис. 10.3 «Атмосферное давление»). Каждая точка на поверхности Земли испытывает чистое давление, называемое атмосферным давлением . Давление, оказываемое атмосферой, является значительным: столб размером 1,0 м 2 , измеренный от уровня моря до верхних слоев атмосферы, имеет массу около 10 000 кг, что дает давление около 100 кПа:
Давление, оказываемое атмосферой, является значительным: столб размером 1,0 м 2 , измеренный от уровня моря до верхних слоев атмосферы, имеет массу около 10 000 кг, что дает давление около 100 кПа:
Уравнение 10.3
давление = (1,0 × 104 кг) (9,807 м / с2) 1,0 м2 = 0,98 × 105 Па = 98 кПаРисунок 10.3 Атмосферное давление
Каждый квадратный метр поверхности Земли поддерживает столб воздуха высотой более 200 км и весом около 10 000 кг на поверхности Земли, в результате чего давление на поверхности составляет 1,01 × 10 5 Н / м 2 . Это соответствует давлению 101 кПа = 760 мм рт. Ст. = 1 атм.
В английских единицах измерения это около 14 фунтов / дюйм. 2 , но мы так привыкли жить под этим давлением, что даже не замечаем этого. Вместо этого мы замечаем изменений давления на давления, например, когда наши уши щелкают в быстрых лифтах в небоскребах или в самолетах во время быстрых изменений высоты. Мы используем атмосферное давление разными способами. Мы можем использовать трубочку для питья, потому что при ее всасывании удаляется воздух и, таким образом, снижается давление внутри соломинки. Атмосферное давление, оказывающее давление на жидкость в стакане, заставляет жидкость подниматься по соломке.
Мы используем атмосферное давление разными способами. Мы можем использовать трубочку для питья, потому что при ее всасывании удаляется воздух и, таким образом, снижается давление внутри соломинки. Атмосферное давление, оказывающее давление на жидкость в стакане, заставляет жидкость подниматься по соломке.
Атмосферное давление можно измерить с помощью барометра — устройства, используемого для измерения атмосферного давления, устройства, изобретенного в 1643 году одним из учеников Галилея, Евангелистой Торричелли (1608–1647). Барометр может быть изготовлен из длинной стеклянной трубки, закрытой с одного конца. Он наполнен ртутью и помещен вверх дном в емкость с ртутью, не допуская попадания воздуха в трубку. Некоторая часть ртути вытечет из трубки, но внутри остается относительно высокий столбик (Рисунок 10.4 «Ртутный барометр»). Почему не заканчивается ртуть? Гравитация, безусловно, оказывает на ртуть в трубке нисходящую силу, но ей противодействует давление атмосферы, давящее на поверхность ртути в чаше, что в итоге приводит к выталкиванию ртути вверх в трубку. Поскольку над ртутью внутри трубки в правильно заполненном барометре (он содержит вакуум ) нет воздуха над ртутью, на колонку нет давления. Таким образом, ртуть вытекает из трубки до тех пор, пока давление самого ртутного столба точно не уравновесит давление атмосферы.При нормальных погодных условиях на уровне моря две силы уравновешиваются, когда верхняя часть ртутного столба находится примерно на 760 мм выше уровня ртути в чаше, как показано на Рисунке 10.4 «Ртутный барометр». Это значение зависит от метеорологических условий и высоты. Например, в Денвере, штат Колорадо, на высоте около 1 мили или 1609 м (5280 футов) высота ртутного столба составляет 630 мм, а не 760 мм.
Поскольку над ртутью внутри трубки в правильно заполненном барометре (он содержит вакуум ) нет воздуха над ртутью, на колонку нет давления. Таким образом, ртуть вытекает из трубки до тех пор, пока давление самого ртутного столба точно не уравновесит давление атмосферы.При нормальных погодных условиях на уровне моря две силы уравновешиваются, когда верхняя часть ртутного столба находится примерно на 760 мм выше уровня ртути в чаше, как показано на Рисунке 10.4 «Ртутный барометр». Это значение зависит от метеорологических условий и высоты. Например, в Денвере, штат Колорадо, на высоте около 1 мили или 1609 м (5280 футов) высота ртутного столба составляет 630 мм, а не 760 мм.
Рисунок 10.4 Ртутный барометр
Давление, оказываемое атмосферой на поверхность ртутного бассейна, поддерживает столб ртути в трубке высотой около 760 мм.Поскольку точка кипения ртути довольно высока (356,73 ° C), в пространстве над ртутным столбом очень мало паров ртути.
Ртутные барометры использовались для измерения атмосферного давления так долго, что у них есть собственная единица измерения давления: миллиметр ртутного столба (мм рт. Ст.). Единица давления, часто называемая торр., Часто называемая единицей давления торр. Один торр равен 1 мм рт. Ст. После Торричелли. Стандартное атмосферное давление Атмосферное давление, необходимое для поддержки столба ртути высотой ровно 760 мм, который также называется 1 атмосферой (атм).атмосферное давление, необходимое для поддержания столба ртути высотой точно 760 мм; это давление также обозначается как 1 атмосфера (атм.). Также называется стандартным атмосферным давлением. Это атмосферное давление, необходимое для поддержания столба ртути высотой ровно 760 мм. Эти единицы также относятся к паскалям:
Уравнение 10.4
1 атм = 760 мм рт. Ст. = 760 торр = 1,01325 × 10 5 Па = 101,325 кПа Таким образом, давление в 1 атм в точности равно 760 мм рт. Ст. И приблизительно равно 100 кПа.
Ст. И приблизительно равно 100 кПа.
Пример 3
Один из авторов несколько лет назад посетил национальный парк Роки-Маунтин. После вылета из аэропорта на уровне моря на востоке Соединенных Штатов он прибыл в Денвер (высота 5280 футов), арендовал автомобиль и поехал на вершину шоссе за пределами Эстес-парка (высота 14 000 футов). Он заметил, что на этой высоте, где атмосферное давление всего 454 мм рт. Преобразуйте это давление в
Дано: Давление в миллиметрах ртутного столба
Запрошено: Давление в атмосферах и килопаскалях
Стратегия:
Используйте коэффициенты преобразования в уравнении 10.4, чтобы преобразовать миллиметры ртутного столба в атмосферу и килопаскали.
Решение:
Из уравнения 10.4 имеем 1 атм = 760 мм рт. Ст. = 101,325 кПа. Таким образом, давление на высоте 14000 футов в атм составляет
. P = (454 мм рт. Ст.) (1 атм. 760 мм рт. Ст.) = 0,597 атм.Давление в кПа равно
. P = (0,597 атм) (101,325 кПа1 атм) = 60,5 кПаУпражнение
Mt. Эверест, расположенный на высоте 29 028 футов над уровнем моря, является самой высокой горой в мире. Нормальное атмосферное давление на этой высоте составляет около 0,308 атм.Преобразуйте это давление в
Ответ: а. 234 мм рт. Ст .; б. 31,2 кПа
Манометры
Барометры измеряют атмосферное давление, а манометры — устройство, используемое для измерения давления проб газов, содержащихся в аппарате.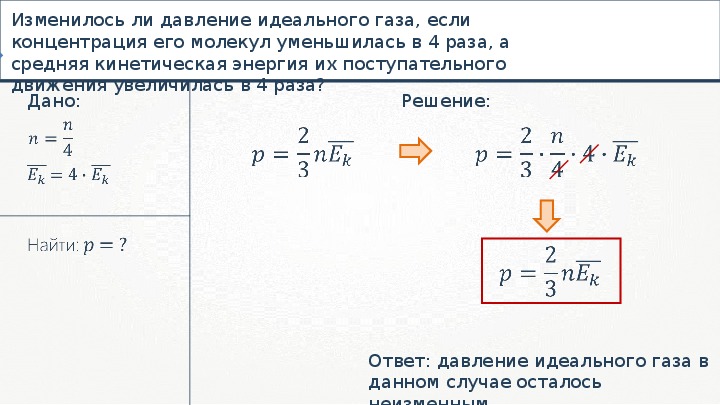 измерить давление проб газов, содержащихся в аппарате. Ключевой особенностью манометра является U-образная трубка, содержащая ртуть (или иногда другую нелетучую жидкость).Манометр с закрытым концом схематично показан в части (а) на рисунке 10.5 «Два типа манометров». Когда колба не содержит газа (т. Е. Когда ее внутренняя часть близка к вакууму), высота двух столбов ртути одинакова, потому что пространство над ртутью слева — это почти вакуум (он содержит только следы паров ртути. ). Если газ будет выпущен в колбу справа, он окажет давление на ртуть в правом столбце, и два столбца ртути больше не будут одинаковой высоты.Разница между высотами двух колонн равна давлению газа.
измерить давление проб газов, содержащихся в аппарате. Ключевой особенностью манометра является U-образная трубка, содержащая ртуть (или иногда другую нелетучую жидкость).Манометр с закрытым концом схематично показан в части (а) на рисунке 10.5 «Два типа манометров». Когда колба не содержит газа (т. Е. Когда ее внутренняя часть близка к вакууму), высота двух столбов ртути одинакова, потому что пространство над ртутью слева — это почти вакуум (он содержит только следы паров ртути. ). Если газ будет выпущен в колбу справа, он окажет давление на ртуть в правом столбце, и два столбца ртути больше не будут одинаковой высоты.Разница между высотами двух колонн равна давлению газа.
Рисунок 10.5 Два типа манометров
(a) В манометре с закрытым концом пространство над ртутным столбиком слева (эталонное плечо) по существу представляет собой вакуум ( P ≈ 0), а разница в высоте двух столбцов дает давление газа, содержащегося непосредственно в баллоне. (b) В манометре с открытым концом левое (эталонное) плечо открыто для атмосферы ( P ≈ 1 атм), а разница в высоте двух столбцов дает разность между атмосферным давлением и атмосферным давлением. давление газа в баллоне.
(b) В манометре с открытым концом левое (эталонное) плечо открыто для атмосферы ( P ≈ 1 атм), а разница в высоте двух столбцов дает разность между атмосферным давлением и атмосферным давлением. давление газа в баллоне.
Если трубка открыта для атмосферы, а не закрыта, как в манометре с открытым концом, показанном в части (b) на рисунке 10.5 «Два типа манометров», то два столбика ртути имеют одинаковую высоту, только если газ в баллоне имеет давление, равное атмосферному давлению. Если давление газа в баллоне на выше , ртуть в открытой трубке будет вытесняться газом, давящим вниз на ртуть в другом плече U-образной трубки. Таким образом, давление газа в баллоне складывается из атмосферного давления (измеренного с помощью барометра) и разницы в высоте двух столбцов.Если газ в баллоне имеет давление на меньше, чем давление атмосферы, то высота ртути будет больше в рычаге, прикрепленном к баллоне. В этом случае давление газа в баллоне равно атмосферному давлению за вычетом разницы в высоте двух колонн.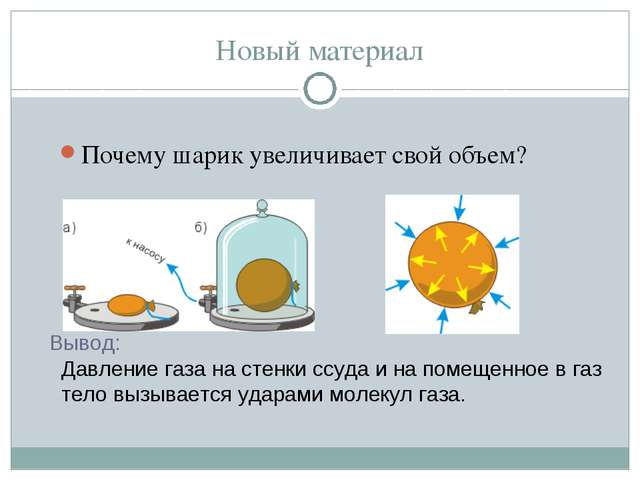
Пример 4
Предположим, вы хотите построить манометр с закрытым концом для измерения давления газа в диапазоне 0,000–0,200 атм. Из-за токсичности ртути вы решаете использовать воду, а не ртуть.Какой высоты вам нужен столб воды? (При 25 ° C плотность воды составляет 0,9970 г / см 3 ; плотность ртути составляет 13,53 г / см 3 .)
Дано: Диапазон давления и плотности воды и ртути
Запрошено: высота столбца
Стратегия:
A Вычислите высоту столбика ртути, соответствующего 0.200 атм в миллиметрах ртутного столба. Это высота, необходимая для столбца, заполненного ртутью.
B Из заданных плотностей используйте пропорцию, чтобы вычислить высоту, необходимую для столбца, заполненного водой.
Решение:
A В миллиметрах ртутного столба давление газа 0,200 атм равно
P = (0,200 атм) (760 мм рт. Ст. 1 атм) = 152 мм рт.Для использования ртутного манометра вам понадобится ртутный столбик высотой не менее 152 мм.
B Поскольку вода менее плотная, чем ртуть, вам понадобится на более высокий столб воды, чтобы достичь того же давления, что и данный столб ртути. Высота, необходимая для наполненного водой столба, соответствующего давлению 0,200 атм, пропорциональна отношению плотности ртути (dHg) к плотности воды (dh3O):
(heighth3O) (dh3O) = (heightHg) (dHg) heighth3O = (heightHg) (dHgdh3O) = (152 мм) (13,53 г / см30,9970 г / см3) = 2.06 × 103 мм h3O = 2,06 м h3O Этот ответ имеет смысл: для достижения того же давления требуется более высокий столб менее плотной жидкости.
Упражнение
Предположим, вы хотите разработать барометр для измерения атмосферного давления в среде, температура которой всегда превышает 30 ° C. Чтобы избежать использования ртути, вы решили использовать галлий, плавящийся при 29,76 ° C; плотность жидкого галлия при 25 ° C составляет 6,114 г / см 3 . Какой высоты вам нужен столбик галлия, если P = 1.00 атм?
Ответ: 1,68 м
Ответ на пример 4 также сообщает нам максимальную глубину фермерского колодца, если для откачки воды будет использоваться простой всасывающий насос. Если столб воды высотой 2,06 м соответствует 0,200 атм, то 1,00 атм соответствует высоте столба
. h3.06 м = 1,00 атм. 0,200 атм. h = 10,3 м Всасывающий насос — это просто более сложная версия соломинки: он создает вакуум над жидкостью и использует атмосферное давление, чтобы поднять жидкость вверх по трубке. Если давление в 1 атм соответствует столбу воды 10,3 м (33,8 фута), то при атмосферном давлении физически невозможно поднять воду в колодце выше этого значения. До тех пор, пока не были изобретены электрические насосы для механического выталкивания воды с больших глубин, этот фактор сильно ограничивал место проживания людей, поскольку добывать воду из колодцев глубиной более 33 футов было трудно.
Если давление в 1 атм соответствует столбу воды 10,3 м (33,8 фута), то при атмосферном давлении физически невозможно поднять воду в колодце выше этого значения. До тех пор, пока не были изобретены электрические насосы для механического выталкивания воды с больших глубин, этот фактор сильно ограничивал место проживания людей, поскольку добывать воду из колодцев глубиной более 33 футов было трудно.
Сводка
Для полного физического описания образца газа должны быть известны четыре величины: температура , объем , количество и давление . Давление — сила на единицу площади поверхности; единицей измерения давления в системе СИ является паскаль (Па) , определяемая как 1 ньютон на квадратный метр (Н / м 2 ). Давление, оказываемое объектом, пропорционально силе, которую он оказывает, и обратно пропорционально площади, на которую действует сила. Давление атмосферы Земли, называемое атмосферным давлением , составляет около 101 кПа или 14,7 фунта / дюйм. 2 на уровне моря. Атмосферное давление можно измерить с помощью барометра , закрытой перевернутой трубки, заполненной ртутью.Высота ртутного столба пропорциональна атмосферному давлению, которое часто выражается в единицах миллиметров ртутного столба (мм рт. Ст.) , также называемых торр . Стандартное атмосферное давление , давление, необходимое для поддержки столба ртути высотой 760 мм, является еще одной единицей давления: 1 атмосфера (атм) . Манометр — это прибор, используемый для измерения давления пробы газа.
2 на уровне моря. Атмосферное давление можно измерить с помощью барометра , закрытой перевернутой трубки, заполненной ртутью.Высота ртутного столба пропорциональна атмосферному давлению, которое часто выражается в единицах миллиметров ртутного столба (мм рт. Ст.) , также называемых торр . Стандартное атмосферное давление , давление, необходимое для поддержки столба ртути высотой 760 мм, является еще одной единицей давления: 1 атмосфера (атм) . Манометр — это прибор, используемый для измерения давления пробы газа.
Ключевые вынос
Концептуальные проблемы
Ответ
Числовые задачи
Ответ
Давление газа
Важное свойство любого газа
это его давление . У нас есть опыт работы с газом
давление, которого у нас нет с такими свойствами, как
вязкость
и сжимаемость. Каждый день мы слышим, как метеоролог по телевизору дает
значение барометрического давления
атмосфера
(29.8 дюймов
ртуть, например). И большинство из нас надували воздушный шар или использовали
насос для накачивания велосипедной шины или баскетбольного мяча.
Каждый день мы слышим, как метеоролог по телевизору дает
значение барометрического давления
атмосфера
(29.8 дюймов
ртуть, например). И большинство из нас надували воздушный шар или использовали
насос для накачивания велосипедной шины или баскетбольного мяча.
Потому что понимание того, что такое давление и как оно работает, так
фундаментальные для понимания аэродинамики, мы включаем
несколько слайдов о давлении газа в Руководстве для начинающих. An
интерактивный симулятор атмосферы
позволяет учиться
как статическое давление воздуха меняется с высотой. В
Программа FoilSim
показывает, как изменяется давление вокруг подъемного крыла, а
Программа EngineSim
показывает, как изменяется давление в газотурбинном двигателе.Другой симулятор поможет вам изучить, как изменяется давление в
ударные волны, возникающие на высоких скоростях.
Есть два способа взглянуть на давление: (1) мелкомасштабное действие
отдельных молекул воздуха или (2) крупномасштабное действие большого
количество молекул.
Молекулярное определение давления
От
кинетическая теория газов, газ составлен
большого количества молекул, которые очень малы по сравнению с
расстояние между молекулами.Молекулы
газ
находятся в постоянном, случайном
движения и часто сталкиваются друг с другом и со стенками
любой контейнер. Молекулы обладают физическими свойствами массы,
импульс и энергия.
Импульс отдельной молекулы равен
произведение его массы и скорости, а кинетическая энергия равна одному
половина массы, умноженная на квадрат скорости.
Поскольку молекулы газа сталкиваются со стенками
контейнер, как показано слева на рисунке, молекулы передают
импульс к стенам, создающий силу перпендикулярно стене .Сумма сил всех молекул, ударяющихся о стенку, деленная на площадь
стенка определяется как давление . Давление газа равно
затем мера среднего количества движения движущихся молекул газа.
Давление действует перпендикулярно (перпендикулярно) стене; тангенциальный (сдвиг)
составляющая силы связана с
вязкость
газа.
Скалярная величина
Давайте посмотрим на статический газ; тот, который, кажется, не движется или не течет.Хотя газ в целом не движется, отдельные
молекулы газа, которые мы не видим, находятся в постоянном случайном
движение. Поскольку мы имеем дело с почти бесконечным числом молекул
и поскольку движение отдельных молекул
случайным образом во всех направлениях, мы не обнаруживаем никакого движения. Если мы
заключаем газ в контейнер, мы обнаруживаем давление в
газ из молекул, сталкивающихся со стенками нашего контейнера. Мы
может поставить стенки нашего контейнера где угодно внутри газа, а сила на площадь (давление) то же самое.Мы можем уменьшить размер нашего «контейнера» до
бесконечно малая точка, а давление имеет единственное значение
в таком случае. Следовательно, давление — это
скаляр
количество, а не
векторное количество. Он имеет величину, но не направление, связанное с
Это. Давление действует во всех направлениях в точке внутри газа. На
поверхности газа сила давления действует перпендикулярно
поверхность.
На
поверхности газа сила давления действует перпендикулярно
поверхность.
Если газ в целом движется, измеренное давление отличается в направление движения.Упорядоченное движение газа производит упорядоченную составляющую импульса в направление движения. Мы связываем дополнительное давление компонент, называемый динамическое давление с этим движением жидкости. Давление, измеренное в направлении движения, называется полное давление и равно сумме статического и динамического давления, описываемого уравнением Бернулли.
Макромасштаб Определение давления
В более крупном масштабе давление — это
переменная состояния
газа, как
температура и
плотность.Изменение давления во время любого процесса
регулируется законами
термодинамика.
Вы можете изучить влияние давления на другие параметры газа.
в анимационной газовой лаборатории.
Хотя само давление является скаляром, мы можем определить
сила давления
быть равным давлению (сила / площадь), умноженному на поверхность
площадь
в направлении, перпендикулярном поверхности. Сила давления — это вектор , величина .
Сила давления — это вектор , величина .
Силы давления обладают некоторыми уникальными качествами по сравнению с гравитационными. или механические силы.На рисунке, показанном выше справа, у нас есть красный газ что заключено в коробку. Механическая сила прилагается к верхней части коробка. Сила давления внутри коробки противостоит приложенной силе согласно Ньютону третий закон движения. Скалярное давление равно внешней силе, деленной на площадь вершины. коробки. Внутри газа давление действует во всех направлениях. Так давление давит на дно коробки и на стороны. Это отличается от простой механики твердого тела. Если красный газ был твердым телом, не было бы сил, приложенных к бокам коробки; приложенная сила будет просто передана на дно. Но в газе, потому что молекулы могут свободно перемещаться и сталкиваются друг с другом, сила, приложенная по вертикали Направление вызывает силы в горизонтальном направлении.
Действия:
Экскурсии с гидом
Навигация. .
.
Курт Дж. Лескер Компания | Технические примечания по измерению давления
Измерение давления
Единицы измерения
Давление ниже атмосферного измеряется в нескольких единицах, включая: торр (также называемый миллиметрами ртутного столба, мм рт. Па).В США обычно используются три единицы измерения: микрон как единица измерения давлений, достигаемых обратными насосами, торр для насосов высокого вакуума и сверхвысокого вакуума и дюймы ртутного столба для насосов грубой очистки. В Европе миллибар является общей единицей измерения давления. В Японии используется паскаль, но часто торр является второстепенным. Большинству авторов научных / технических статей рекомендуется использовать паскаль в единицах СИ, а некоторые и делают.
Единицы производны от:
Диапазоны давления
Не существует «универсального» манометра, который мог бы измерять давление от атмосферного до сверхвысокого (динамический диапазон 10 15 ).
По сути, для измерения давления используются три механизма, и выбор одного из них зависит от диапазона давления и остаточных газов в вакууме.
Базовые технологии:
Механические манометры имеют жидкостные или твердые диафрагмы, которые меняют положение под действием всех молекул газа, отскакивающих от них.Эти манометры измеряют абсолютное давление, не зависящее от свойств газа / пара. К сожалению, этот тип манометра неэффективен ниже 10 -5 Торр.
Приборы для измерения свойств газа измеряют объемные свойства, такие как теплопроводность или вязкость. Они зависят от состава газа и эффективны в ограниченном диапазоне давлений от атмосферного до 10 -4 Торр.
Ионизационные манометры Для измерений в условиях высокого вакуума и сверхвысокого напряжения используется сбор заряда.Молекулы остаточного газа ионизируются электронами, и измеряется результирующий ионный ток.
Хотя такие манометры будут ионизировать пары, а также постоянные газы, их реакция зависит от других параметров, кроме потенциала ионизации, что затрудняет точное измерение общего давления в газовых смесях. Ионизационные манометры охватывают диапазон давлений от 10 -4 Торр до 10 -10 Торр.
Ионизационные манометры охватывают диапазон давлений от 10 -4 Торр до 10 -10 Торр.
Типичное расположение двух датчиков, охватывающих интересующий диапазон от атмосферы до 1 x 10 9 Торр, оставляет плохо закрытую полосу при давлениях, широко используемых при напылении, травлении, CVD и т. Д.К счастью, точные измерения, необходимые для воспроизводимой обработки между 10 -1 и 10 -3 Торр, могут быть выполнены путем добавления третьего датчика — емкостного манометра.
При выборе манометра, помимо диапазона давления, следует учитывать и другие характеристики: скорость откачки манометра; как на него влияют радиация, магнетизм, температура, вибрация и агрессивные газы; и повреждения, вызванные его включением при атмосферном давлении.Эти вопросы обсуждаются ниже в разделе «Как задать параметры в манометре», но их также можно найти в обширных текстах о вакууме, таких как «Руководство пользователя по вакуумной технологии» Джона Ф. О’Хэнлона A.
О’Хэнлона A.
Вакуумметры
Механические манометры
Давление газа — это сумма всех индивидуальных сил, вызванных каждым атомом или молекулой, сталкивающейся с поверхностью в любой момент. Механические датчики регистрируют эту общую силу, отслеживая движение поверхности против (восстанавливающей) силы, пытаясь удержать поверхность в исходном месте.Поскольку механические датчики реагируют только на молекулярный импульс, они измеряют давление любого газа или пара. Они могут быть очень точными или неточными в зависимости от того, как регистрируется движение.
Маклеод
Этот манометр, хотя и редко используется, в основном используется в качестве основного калибровочного стандарта для других манометров.
Фактически, большой известный объем газа при неизвестном давлении улавливается в стеклянной колбе и сжимается за счет повышения уровня ртути до тех пор, пока газ не окажется в небольшом закрытом капилляре известного объема.Поскольку соотношение между исходным и конечным объемами известно и конечное давление можно измерить, исходное давление рассчитывается по закону Бойля (P1 x V1 = P2 x V2). Манометры МакЛеода особенно полезны в диапазоне от 1 Торр до 10 -4 Торр, но из-за сжатия не могут использоваться для измерения паров.
Манометры МакЛеода особенно полезны в диапазоне от 1 Торр до 10 -4 Торр, но из-за сжатия не могут использоваться для измерения паров.
Бурдон
Бурдон
Типовые характеристики:
Когда закрытая изогнутая трубка овального сечения из медного сплава подключается к вакууму, атмосферное давление изгибает ее в большей или меньшей степени, в зависимости от внутреннего давления.Механическая сила перемещает стрелку индикатора через зубчатую связь.
Манометры Бурдона используются в основном при измерении высокого давления (чаще всего присоединяются к регуляторам на газовых баллонах), но их вариации предназначены для измерения давления от 0 до 30 дюймов ртутного столба и используются для сублимационной сушки, «домашних» вакуумных систем, вакуума. пропитка и т. д., где основной проблемой является наличие вакуума, а не его точное измерение.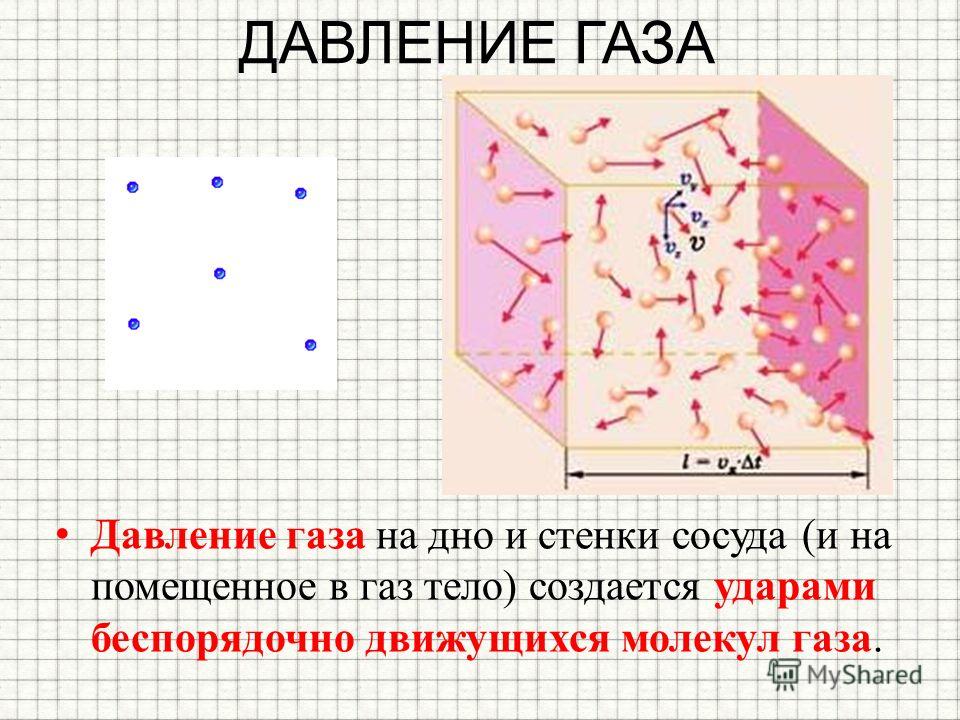
Пьезо
Типовые характеристики:
Пьезорезистивные датчики давления обычно состоят из кремниевой пластины, которая обрабатывается на поверхности, которая превращает кристалл в подходящую отклоняющую диафрагму при воздействии нормального напряжения (давления). Толщина кристалла кремния в его минимальном сечении является основным фактором, определяющим диапазон давления манометра от 1500 до 0.1 торр. По мере того как диафрагма отклоняется под давлением, сопротивление пьезорезистивных элементов изменяется по величине, в результате чего сеть моста Уитстона выходит из равновесия. Подача напряжения на этот мост создает выходное напряжение, пропорциональное приложенному давлению. Если элементы имеют одинаковое сопротивление, будет нулевое выходное напряжение без перепада давления на диафрагме.
Емкостные манометры
Манометр
Типовые характеристики:
Отклонение тонкой металлической диафрагмы, отделяющей известное давление от неизвестного, является мерой разницы давлений между двумя объемами. В емкостном манометре, как следует из названия, отклонение измеряется с использованием электрической емкости между диафрагмой и некоторыми неподвижными электродами.Емкостные манометры — самые точные устройства для измерения перепада или абсолютного давления всех газов (включая пары, которые не конденсируются при рабочей температуре манометра).
Измерительные головки указаны по их максимальному измеренному давлению (от 25 000 торр до 1 x 10 -1 торр), при этом каждая головка имеет динамический диапазон примерно на 10 4 ниже этого. Обычно точность показаний манометра составляет 0,25%, а 0,08% можно получить из высокоточных продуктов.
Обычно точность показаний манометра составляет 0,25%, а 0,08% можно получить из высокоточных продуктов.
В то время как манометры имеют заданную рабочую температуру, емкостные манометры можно настроить (перед покупкой) для работы при температурах выше окружающей среды. Эти «нагретые» блоки имеют внутри блока нагреватель, который нагревает мембрану до заданной температуры (например, 100 ° C). Это помогает поддерживать точность емкостного манометра, а также помогает уменьшить конденсацию паров на диафрагме (до тех пор, пока внутренняя температурная компенсация устройства не будет выше, чем температура процесса).
Диафрагменные манометры
Как и емкостной манометр, эти манометры используют отклонение тонкой металлической (или кремниевой) диафрагмы, отделяющей известное давление от неизвестного.
Однако в этом типе датчика отклонение определяется тензодатчиком, прикрепленным к диафрагме.
Хотя это ограничивает минимальное измеряемое давление до 1 торр, оно обеспечивает стабильные, воспроизводимые показания устройства до 1200 торр.
Приборы для измерения состояния газа
Значения теплопроводности или вязкости для каждого конкретного газа различаются и нелинейно зависят от давления.Измерители свойств газа, представленные для типичных газов вакуумной камеры, неточны. Это и множество других источников неотъемлемой погрешности позволяют предположить, что показания манометра приемлемы для регистрации повторяющихся событий давления, но мало пригодны для измерения абсолютного давления.
Термопара
Термопара (T / C)
Типовые характеристики:
Нить накала в датчике термопары нагревается до определенной температуры с помощью постоянного тока. Когда молекулы взаимодействуют с нитью, тепло передается с заданной скоростью (в зависимости от теплопроводности молекул), что вызывает разницу температур. Эта переменная температура измеряется и преобразуется в выходное напряжение, за которым следует давление. Чем выше давление (больше молекул), тем больше перепад температур. Из-за конструкции датчика и размещения нити накала датчики с термопарой обычно не используются для измерений выше 10 Торр, поскольку множество молекул имеет тенденцию сливаться на определенной части нити, что приводит к неточности.
Когда молекулы взаимодействуют с нитью, тепло передается с заданной скоростью (в зависимости от теплопроводности молекул), что вызывает разницу температур. Эта переменная температура измеряется и преобразуется в выходное напряжение, за которым следует давление. Чем выше давление (больше молекул), тем больше перепад температур. Из-за конструкции датчика и размещения нити накала датчики с термопарой обычно не используются для измерений выше 10 Торр, поскольку множество молекул имеет тенденцию сливаться на определенной части нити, что приводит к неточности.
Со временем молекулы прилипают к нити, что приводит к неточным измерениям. В зависимости от того, чему подвергался манометр, нить накала можно очистить, налив небольшое количество растворителя на концевую часть фланца, установив контакт с нитью (при выключенном манометре). Это должно быть сделано после анализа SDS растворителя и молекул, используемых в процессе. Оказавшись внутри, устройство можно осторожно покрутить (не как марака), чтобы растворитель вступил в контакт со всей нитью, в надежде растворить некоторые, если не все, застрявшие молекулы. После этого растворитель будет подвергнут надлежащему воздействию, и все остаточные количества будут испарены. Это можно ускорить, включив устройство, которое будет обеспечивать тепло. Эта очистка не гарантирована, так как некоторые молекулы могли вызвать коррозию нити. В этом случае предлагается заменить датчик.
После этого растворитель будет подвергнут надлежащему воздействию, и все остаточные количества будут испарены. Это можно ускорить, включив устройство, которое будет обеспечивать тепло. Эта очистка не гарантирована, так как некоторые молекулы могли вызвать коррозию нити. В этом случае предлагается заменить датчик.
Пирани
Пирани
Типовые характеристики:
В датчике Пирани две нити, часто платиновые, используются в качестве двух плеч моста Уитстона.Эталонная нить накала погружается в газ с фиксированным давлением, а измерительная нить подвергается воздействию системного газа.
Обе нити накала нагреваются током через мост, но, в отличие от большинства Т / К, датчик Пирани не использует постоянное напряжение или мощность, а постоянную температуру нити. Молекулы газа, ударяясь о погруженный элемент, отводят энергию, которая обнаруживается и заменяется цепью обратной связи к источнику питания.
Датчик Пирани будет измерять в том же диапазоне, что и датчик термопары, но увеличен до 1e -4 Торр.Однако этот датчик имеет ту же проблему, что и датчик термопары выше 10 торр.
Молекулы газа, ударяясь о погруженный элемент, отводят энергию, которая обнаруживается и заменяется цепью обратной связи к источнику питания.
Датчик Пирани будет измерять в том же диапазоне, что и датчик термопары, но увеличен до 1e -4 Торр.Однако этот датчик имеет ту же проблему, что и датчик термопары выше 10 торр.
Со временем молекулы будут прилипать к нити, что приведет к неточным измерениям. В зависимости от того, чему подвергался манометр, нить накала можно очистить, налив небольшое количество растворителя на концевую часть фланца, установив контакт с нитью (при выключенном манометре). Это должно быть сделано после анализа SDS растворителя и молекул, используемых в процессе. Оказавшись внутри, устройство можно осторожно покрутить (не как марака), чтобы растворитель вступил в контакт со всей нитью, в надежде растворить некоторые, если не все, застрявшие молекулы.После этого растворитель будет подвергнут надлежащему воздействию, и все остаточные количества будут испарены. Это можно ускорить, включив устройство, которое будет обеспечивать тепло. Эта очистка не гарантирована, так как некоторые молекулы могли вызвать коррозию нити. В этом случае предлагается заменить датчик.
Это можно ускорить, включив устройство, которое будет обеспечивать тепло. Эта очистка не гарантирована, так как некоторые молекулы могли вызвать коррозию нити. В этом случае предлагается заменить датчик.
Конвекция
Пирани с улучшенной конвекцией
Типовые характеристики:
Пирани с улучшенной конвекцией очень похож на датчик Пирани в том, что на нить накала подается ток для поддержания постоянной температуры.Когда молекулы взаимодействуют с нитью, тепло от нити отводится, и для поддержания постоянной температуры требуется больше тока. Этот перепад тока преобразуется в напряжение, а затем в давление. Однако такая конструкция датчика позволяет равномерно перемещаться вокруг нити за счет конвекции (правильного воздушного потока). Это сводит к минимуму карманы молекул, прилипающих к определенной части нити, обеспечивая более точное считывание. Это помогает поддерживать точность выше 10 торр.
Это сводит к минимуму карманы молекул, прилипающих к определенной части нити, обеспечивая более точное считывание. Это помогает поддерживать точность выше 10 торр.
Со временем молекулы будут прилипать к нити, что приведет к неточным измерениям.В зависимости от того, чему подвергался манометр, нить накала можно очистить, налив небольшое количество растворителя на концевую часть фланца, установив контакт с нитью (при выключенном манометре). Это должно быть сделано после анализа SDS растворителя и молекул, используемых в процессе. Оказавшись внутри, устройство можно осторожно покрутить (не как марака), чтобы растворитель вступил в контакт со всей нитью, в надежде растворить некоторые, если не все, застрявшие молекулы.После этого растворитель будет подвергнут надлежащему воздействию, и все остаточные количества будут испарены. Это можно ускорить, включив устройство, которое будет обеспечивать тепло. Эта очистка не гарантирована, так как некоторые молекулы могли вызвать коррозию нити. В этом случае предлагается заменить датчик.
В этом случае предлагается заменить датчик.
Ионизационные манометры
Все ионизационные датчики с относительно небольшими различиями используют один и тот же принцип. Энергичные электроны ионизируют остаточные газы — положительные ионы собираются на электроде, и ток преобразуется в показания давления.Датчики с горячей нитью (Bayard-Alpert, Schulz-Phelps) используют термоэлектронную эмиссию электронов из горячей проволоки, а датчики с холодным катодом (Penning, Inverted Magnetron) используют электроны из тлеющего разряда или плазмы.
На все измерения ионным манометром серьезно влияет состав газа.
Например, отчет в J. Vac. Sci. Tech. указывает, что относительная чувствительность ионного датчика (относительно N 2 = 1) составляет 5 для паров ацетона и 0,18 для He.
То есть, одинаковое абсолютное давление этих чистых (газообразных) материалов даст показания манометра, отличающиеся почти в 28 раз.Ионизационные манометры не дают точных измерений абсолютного давления, если они не были недавно откалиброваны с использованием точной газовой смеси, которая должна быть измерена.
Чувствительность
Термин относительная чувствительность, использованный выше, не следует путать с параметром, называемым «чувствительность датчика». Последнее происходит из уравнения, связывающего ток положительных ионов датчика (i p ) для данной эмиссии электронов (i e ) при данном давлении газа (P): i p = S xi e x P или P = 1 / S xi p / i e
Константа пропорциональности (S в единицах обратного давления) — это чувствительность датчика.’ Практические (накаливания) ионные манометры имеют чувствительность в диапазоне от 0,6 торр -1 до 20 торр -1 . Это важно при выборе контроллера ионного датчика, поскольку его чувствительность должна находиться в пределах доступного диапазона контроллера. Чем выше чувствительность датчика, тем выше вероятность ионизации молекулы.
Манометры горячей нити
Ион
Типовые характеристики:
Два обычных ионных манометра с горячей нитью накала, Bayard / Alpert (B-A) и Schulz-Phelps (S-P), отличаются только физическим размером и расстоянием между их электродами. Обе имеют нагретые нити, смещенные для получения термоэлектронных электронов с напряжением 70 эВ, достаточно энергичных, чтобы ионизировать любые молекулы остаточного газа, с которыми они сталкиваются.
Образовавшиеся положительные ионы перемещаются в коллектор ионов, поддерживаемый при -150 В.
Сила тока зависит от плотности газа (количества молекул в каждом куб. См), которая является прямой мерой давления газа.
Обе имеют нагретые нити, смещенные для получения термоэлектронных электронов с напряжением 70 эВ, достаточно энергичных, чтобы ионизировать любые молекулы остаточного газа, с которыми они сталкиваются.
Образовавшиеся положительные ионы перемещаются в коллектор ионов, поддерживаемый при -150 В.
Сила тока зависит от плотности газа (количества молекул в каждом куб. См), которая является прямой мерой давления газа.
Со временем датчик с горячей нитью накапливает множество ионизированных молекул, которые необходимо удалить для поддержания точности датчика.Это легко сделать путем «дегазации» агрегата. Это обычная практика с любым датчиком с горячей нитью накала, когда через сеть и коллектор пропускается сильный ток, по существу, спекающий эти части. Этот «прогрев» помогает удалить эти ионизированные молекулы, возвращая устройство в чистое состояние. Однако дегазация не гарантирует удаление всех молекул, поскольку некоторые из них останутся прилипшими к коллектору или даже могут вызвать эрозию. В таких случаях рекомендуется заменить датчик.
В таких случаях рекомендуется заменить датчик.
Ионный манометр Bayard-Alpert имеет достаточно линейный отклик от 1e -9 до 1e -4 торр, с чувствительностью датчика от 5 до 20 торр -1 .Манометры BA доступны с одной или двумя нитями накала (вторая действует как запасная) и с двумя нитями накала, покрытыми иридием, покрытым торием, используемым в приложениях, богатых кислородом, и для защиты от выгорания при случайном сбросе воздуха, и вольфрам, используемый для нижнего стоимость и в остаточных газах, содержащих галогены.
Стандартный манометр B-A измеряет до 1e -9 торр. Он не опускается ниже, потому что первичные электроны при попадании на сетку генерируют мягкое рентгеновское излучение.
Рентгеновское излучение, попадающее на электрод-коллектор ионов, высвобождает фотоэлектрон, который неотличим от поступающих туда положительных ионов.Ниже 1e -9 Торр фотоэлектронная эмиссия составляет достаточно большую долю ионного тока, чтобы искажать показания давления. Специальные структуры B-A с ультратонкими коллекторами ионов будут достигать 10 -10 Торр и, возможно, даже диапазона 10 -11 Торр.
Специальные структуры B-A с ультратонкими коллекторами ионов будут достигать 10 -10 Торр и, возможно, даже диапазона 10 -11 Торр.
Ионный манометр Nude UHV работает по тому же принципу, что и стандартные датчики Bayard-Alpert, но позволяет проводить более глубокое измерение вакуума, от 1e -11 до 1e -4 Торр.Это изменение базового давления связано с конструкцией манометра, которая включает решетчатую конструкцию в виде корзины и плотные нити.
Манометры с холодным катодом
ColdCathode
Типовые характеристики:
В датчиках с холодным катодом ионизирующие электроны являются частью самоподдерживающегося разряда.Однако, поскольку CCG не имеет (термоэлектронной эмиссии) нити накала, разряд инициируется паразитной полевой эмиссией или внешними событиями (космическими лучами или радиоактивным распадом). При низком давлении это может занять несколько минут, и обычно CCG включаются при высоком давлении (1e -2 Торр или выше).
После запуска магнитное поле датчика удерживает электроны на спиральных траекториях, обеспечивая им большую длину пути и высокую вероятность ионизации остаточного газа.
Ионы собираются и измеряются для определения давления газа.
При низком давлении это может занять несколько минут, и обычно CCG включаются при высоком давлении (1e -2 Торр или выше).
После запуска магнитное поле датчика удерживает электроны на спиральных траекториях, обеспечивая им большую длину пути и высокую вероятность ионизации остаточного газа.
Ионы собираются и измеряются для определения давления газа.
Использовались электроды различной геометрии — цилиндры, пластины, кольца, стержни в различных комбинациях с направлением и силой магнитного поля, выбранными для максимизации измеряемого тока. Если центральные или «концевые» электроды датчика отрицательные, это принято называть магнетроном. Если те же электроды положительные, датчик называется перевернутым магнетроном.
Магнетрон: Первоначальная конструкция Пеннинга (цилиндрический анод и катоды с торцевой пластиной) не была ни точной, ни точной, и ее заменили на другие геометрические формы.Однако название Пеннинга до сих пор используется даже для магнетронов с центральными проволочными или кольцевыми катодами. Рабочее напряжение ограничено (обычно ~ 2 кВ), чтобы избежать эффектов полевой эмиссии, которые вызывают увеличение ионного тока, не связанного с давлением. Хотя новые конструкции магнетронов удовлетворительны, они ограничены верхним диапазоном высокого вакуума и не привлекают большого внимания коммерческой общественности.
Инвертированный магнетрон: Во многом благодаря усилиям Редхеда и его коллег, эта конструкция работает в диапазоне сверхвысокого давления.Его осевой центральный анод входит в катод цилиндра / торцевых пластин через кольца защиты от напряжения (для предотвращения полевой эмиссии, влияющей на измерение ионного тока). Анод имеет гораздо более высокий потенциал, чем нормальный магнетрон (~ 6 кВ), и параллелен магнитному полю датчика. Некоторые коммерчески доступные конструкции перевернутого магнетрона имеют хорошую линейность и рабочие характеристики до 1 x 10 -11 Торр. Однако попытка запустить его при таком низком давлении может занять часы или дни.
В отличие от датчика с горячей нитью, датчик с холодным катодом не имеет нитей или сетки для дегазации. Вместо этого некоторые датчики с холодным катодом могут разбираться, обнажая ионизационную камеру и внутренние стенки датчика. Это воздействие позволяет пользователю буквально протирать внутренние стенки датчика с холодным катодом, помогая удалить молекулы, которые «распылились» на стену. Эта физическая очистка делает датчик с холодным катодом в целом более прочным, чем датчик с горячей нитью.
Комбинированные манометры
Комбинированные датчики, также известные как датчики с широким диапазоном, — это устройства, в которых используются несколько технологий для обеспечения более широкого диапазона измерений, чем любая отдельная технология. Например, наиболее распространенными датчиками широкого диапазона являются комбинация холодного катода / пирани или комбинация горячего накала / усиленной конвекцией пирани. Эти типы позволят проводить измерения от сверхвысокого напряжения до атмосферы. Поскольку в этих приборах сочетаются разные технологии, обычно существует переходный регион, когда одна технология переходит в другую.Наиболее распространенная область между 10 -2 и 10 -3 , где пирани с усилением пирани / конвекции переходят в технологию ионизации с холодным катодом или горячей нитью. Эти блоки обычно находятся в одном корпусе, что помогает минимизировать беспорядок и помогает автоматизировать измерение давления, поскольку пользователю не нужно вручную активировать технологию высокого вакуума.
Анализаторы остаточных газов
Специальные масс-спектрометры, предназначенные для анализа газов, остающихся в вакуумной камере, называются анализаторами остаточных газов или RGA.Обилие информации об экспериментальных или технологических условиях, предлагаемых анализатором арматуры, делает стационарно присоединенное устройство удобным и часто необходимым диагностическим устройством.
Квадрупольные RGA, названные в честь четырех стержней, используемых в секции массового фильтра, питаются от смешанных высокочастотных и постоянных напряжений. Полные рабочие детали выходят за рамки этого текста, но адекватно рассматриваются во многих книгах, таких как Dawson’s Quadrupole Mass Spectrometry And Its Applications и монография AVS Дринквайна и др., Partial Pressure Analyzers and Analysis .Квадрупольный анализатор (или головка датчика) прикручивается к вакуумной системе. Он состоит из ионизатора (источника ионов), подключенного к массовому фильтру, который, в свою очередь, присоединен к ионному детектору, и все они установлены на фланце сверхвысокого вакуума (часто наружный диаметр 2-3⁄4 дюйма), через который проходят вводы для питания и сигналов. . Комбинированное РЧ / постоянное напряжение генерируется рядом с головкой датчика. Отсюда к шасси управления и дисплею или настольному ПК подключается только напряжение основного источника питания и информация о возвращаемом сигнале.В ионизаторе атомы и молекулы нейтрального газа бомбардируются электронами с напряжением 70 эВ от горячей нити. Ионизированные частицы извлекаются в квадруполь, где передаются только те ионы с соответствующим отношением массы к заряду (m / e) для приложенных напряжений RF / DC. Путем изменения РЧ / постоянного напряжения со временем сканируются отношения m / e, и ионный ток на каждой массе записывается в виде спектра.
Для диагностики проблем с вакуумом с помощью RGA требуется только набор моделей фрагментации, по которым можно быстро определить следующее: наличие утечек воздуха и воды; неприемлемые уровни активных газов, таких как O 2 , H 2 и H 2 O, обратный поток масла в насосе, присутствие соединений Fl или Cl; требования к регенерации крионасоса и чистота засыпных газов.Поскольку RGA работает при давлении 10 -4 Торр или ниже, процессы высокого давления анализируются с помощью RGA, установленного во вспомогательной вакуумной системе, часто с мобильной тележкой, перемещаемой на различные вакуумные станции.
Детекторы утечки
Детекторы утечки — это масс-спектрометры, которые обнаруживают только ионы гелия при m / e = 4. Поскольку они специфичны, они обнаруживают чрезвычайно малые концентрации гелия в присутствии большого количества других газов. Как следует из названия, эти устройства определяют наличие утечек и помогают их обнаружить.Превосходные инструкции по обнаружению утечек можно найти в книге Харриса, Modern Vacuum Practice или как часть учебной программы нашего университета Лескера.
Испытуемая камера и течеискатель соединены вакуумной трубкой, и камера откачивается с помощью собственной вакуумной системы течеискателя. Гелий распыляется из тонкого сопла на поверхность камеры, где он вытесняет воздух, диффундирующий через утечку, только тогда, когда зонд направлен на место утечки.Распространенное заблуждение, что давление в камере должно быть низким, прежде чем можно будет начать испытание на герметичность. Фактически, давление в камере ниже 10 -2 Торр требуется редко. Как только впускной клапан течеискателя полностью открыт, дальнейшие усилия по снижению давления в камере только тратят время. Например, во время 11-летнего опыта работы одного оператора по проверке герметичности большинство утечек было обнаружено, в то время как впускной клапан течеискателя был сломан лишь частично. Утечки более 1 x 10 -5 атм см / сек.являются наиболее распространенными — «некоторые» утечки приходились на 1 x 10 -6 атм см3 / сек. В диапазоне 1 x 10 -7 атм см3 / сек было шесть утечек. диапазон, два в диапазоне 1 x 10 -8 атм см / сек. диапазон, и только один в диапазоне 1 x 10 -9 атм см / сек. Поскольку большинство течеискателей имеют минимальную обнаруживаемую скорость утечки 1 x 10 -10 атм куб. См / сек., Чувствительность обнаружения редко является проблемой для обнаружения реальных утечек.
Применение теории моделей частиц к передаче энергии при изменении состояния Что такое внутреннее энергия и скрытое тепло? Движение частиц в газах и давление газа Редакция Доктора Брауна по физике Банкноты Подходит для курсов GCSE / IGCSE Physics / Science или их эквивалент Подиндекс этой страницы
1. ВВЕДЕНИЕ to u петь кинетический теория частиц для объяснения свойств трех различных состояний материи
См. Также Плотность материалов и модель частиц материи , и Более подробные описания состояний материи НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 2. Какова внутренняя энергия вещества (Сокращение KE от кинетической энергии) НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 3. Перенос энергии при изменении состояния и сохранение массы НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 4. Изменения состояния и скрытая теплота 4а. Введение в скрытая теплота и изменения состояния г <=> л <=> с НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 4b.Кривая нагрева — постоянно увеличивая внутреннюю энергию системы НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 4c. Кривая охлаждения — постоянно уменьшая внутреннюю энергию системы НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 4г.Некоторые повседневные примеры скрытого тепло — передача внутренней энергии НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 4e. Определение удельной скрытой теплоты НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 4f.Примеры выработанной удельной скрытой теплоты расчеты НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 5а. Модель частиц газа — движение и давление газа Дополнительные расчеты по газу см. В P-V-T давление-объем-температура газ законы и расчеты НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 5б. Принимая во внимание внутреннее и внешнее давление баллона с газом
Эффекты изменения сумма или температура газа в баллоне
НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 5c.Увеличение запаса энергии газа — работа сделана и температурные эффекты НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 6.Факторы, влияющие на скорость испарения и конденсации НАЧАЛО СТРАНИЦЫ и субиндекс для страницы 7. Какая самая низкая температура возможна? Шкала абсолютных температур Кельвина
НАЧАЛО СТРАНИЦЫ и субиндекс для страницы Версия IGCSE заметки модель частицы скрытая теплота изменений состояния KS4 физика Научные заметки на модель частиц скрытая теплота изменения состояния. руководство по физике. примечания к модели частиц скрытая теплота изменений состояния для школ, колледжей, академий, преподавателей курсов естественных наук, изображений рисунки диаграммы для модели частиц скрытая теплота состояния изменяет научные исправления примечания на скрытая теплота изменения состояния модели частиц для пересмотра модулей физики примечания к темам физики, чтобы помочь в понимании модель частицы скрытая теплота изменения состояния университетские курсы технических наук карьера в области физики вакансии в отрасли технический лаборант стажировки технические стажировки по инженерной физике США 8 класс 9 класс 10 AQA физика GCSE примечания к модели частиц скрытая теплота изменений состояния Edexcel Physical Science Notes on модель частиц скрытой теплоты изменения состояния для OCR 21 века физика наука OCR GCSE Gateway физика наука Примечания WJEC gcse science CCEA / CEA gcse science НАЧАЛО СТРАНИЦЫ и субиндекс для страницы
|
Использование системы инертного газа
Эксплуатация цистерны: Использование системы инертного газа align = «left»> Что такое инертный газ? Это благородный газ, который не вступает в химическую реакцию с какими-либо веществами.Эта неактивная характеристика инертного газа делает его идеальной средой для предотвращения взрыва груза на судах.Судам, перевозящим грузы, выделяющие пары углеводородов, требуется инертизирующий раствор для устранения риска взрывов и пожаров в грузовых танках (танкеры для сырой нефти, танкеры-химовозы, танкеры-продуктовозы, газовозы и т. Д.). Система инертного газа используется для поддержания содержания кислорода ниже 8%, стандарта, установленного Международной морской организацией (IMO). Система предлагает решение для горения, которое создает в процессе горения инертный газ, содержащий менее 8% кислорода, и невзрывоопасную атмосферу в грузовых танках.Огонь нуждается в кислороде, тепле и топливе, чтобы гореть. Удаление одного из элементов в этом огненном треугольнике предотвратит пожар. Основным аспектом подачи инертного газа в любой отсек, содержащий смесь углеводородных газов, является удаление содержания кислорода. Таким образом, система сводит к минимуму риск взрыва.
align = «left»> align = «left»> Трубопровод инертного газа (IG) Устанавливается на всех танкерах дедвейтом более 20000 т и на всех танкерах. с системами мойки сырой нефтью (COW).Трубопровод IG обычно низкоуглеродистая сталь большого диаметра с меньшим диаметром ответвления. Внутренняя поверхность трубопровода инертного газа не обычно разъедают. Внешняя поверхность окрашена, но подвержена коррозии если лакокрасочное покрытие испортилось. Использование системы инертного газа на борту танкеров требует особого внимания. При эксплуатации системы инертного газа следует соблюдать приведенные ниже рекомендации.Во время работы системы инертного газа (IGS)
Содержание кислорода в инертном газе (также называемом IG), подаваемом в грузовые танки, должно составлять 5% или меньше.Однако следует отметить, что слишком низкое содержание кислорода в IG приведет к попаданию других примесей в грузовые танки. Во время работы системы инертного газа (IGS) автоматический регистратор кислорода (O2) и давления IG в магистрали должен быть в рабочем состоянии. Детали начала работы (такие как разгрузка в порту XXX, дата и время отметки и т. Д. Должны быть отмечены в записи) Перед запуском IGS убедитесь в подтверждении безопасности согласно протоколу эксплуатации.Проверка уплотнения палубы и фотоэлектрического выключателя должна быть подтверждена в хорошем состоянии. Кроме того, необходимо следить за состоянием аварийной сигнализации, индикации, а также за правильной работой и последовательностью работы соответствующего оборудования.
Схема системы инертного газа (IGS) align = «center»>
Перед прибытием в порт разгрузки следуйте установленному компанией Контрольному списку разгрузки танкеров для подготовки и проверок / испытаний IGS. Информацию о работе IGS и мерах предосторожности см. В руководстве по эксплуатации IGS, которое прилагается к каждому судну.Запуск системы инертного газа перед входом в порты разгрузки экологически чувствительного характера, где загрязнение воздуха и промывка скруббера могут нарушить экосистему, систему инертного газа следует запустить до посадки лоцмана порта во время входа в порт. Это сделано для того, чтобы установка IGS могла успокоиться и избежать выбросов дыма в виде темной воронки при запуске.
Операции по разгрузке груза
Включите и проверьте IGS перед прибытием в порт выгрузки.Убедитесь, что уровень O2 во всех грузовых нефтяных танках составляет менее 8% (предпочтительно менее 5%) с использованием двухкорпусного (D / H) Operational Record — Отчет о рейсе COT Oxygen / h3S. Кроме того, давление в грузовом танке должно быть снижено до минимального положительного давления IG (минимальное давление 100 мм вод. Ст.). Перед началом операций по разгрузке еще раз убедитесь, что все отверстия грузовых танков плотно закрыты (например, паровые пробки, используемые для измерения танков и т. Д.). Перед запуском IG на палубе необходимо правильно настроить клапаны подачи IG грузового танка (т.е.е., открытие главного клапана подачи IG). Отдельный ключ клапана IG грузового танка должен находиться под контролем старшего офицера.
Контролируйте уровень O2 в грузовом масляном танке, параметры давления и температуру во время операций по выгрузке грузового масла. Во время разгрузки контроль грузовых танков, не подключенных к IGS, должен проводиться тщательно и чаще. Следите за температурой. (в случае перегретых грузов) По завершении выгрузки груза и перед отключением IGS достаточно увеличить давление IG во всех грузовых танках.(Дать возможность понизить температуру внутри грузовых танков).
во время балластного рейса
Поддерживайте давление в грузовых масляных танках во всех грузовых нефтяных танках на уровне не менее 100 мм вод. Ст. Во время балластного рейса. При необходимости запустите установку IGS для повышения давления в резервуаре. Тем не менее, если температура в выпускном отверстии была достаточно повышена, в вышеупомянутом, как правило, нет необходимости. Имейте в виду, что при резком падении температуры окружающей среды это может вызвать попадание воздуха в грузовые масляные танки через клапаны P / V, повышая уровень O2, тем самым создавая взрывоопасную атмосферу внутри грузовых танков.Во время балластного рейса оставьте открытыми клапаны подачи IG в отдельных грузовых танках и контролируйте давление в магистрали IG из поста управления грузовыми операциями или с мостика.
Рис: Танкер-продуктовоз STENA PARIS
align = «center»>
Погрузочно-разгрузочные работы
Убедитесь, что уровень O2 во всех грузовых нефтяных танках составляет менее 8% и что давление в танках составляет не менее 100 мм вод. Ст. По прибытии в порт погрузки с использованием двойного корпуса (Д / Н). Рекорд рейса по содержанию COT Oxygen / h3S.В определенных портах максимальное содержание кислорода в инертном газе в грузовых танках может составлять 5% для соответствия особым требованиям безопасности, таким как работа системы контроля выбросов паров. В таких случаях соблюдайте требования к клеммам. В отношении особых требований к условиям и ограничениям атмосферы прибывающих танков, перед загрузкой следуйте применимым требованиям местного порта / терминала. Во время грузовых нефтеналивных операций работа IGS не требуется.
Вторичная вентиляция
Проверяющие инспекторы время от времени ставят под сомнение вопрос о вторичной вентиляции и производительности оборудования.Суда, оснащенные полнопоточным клапаном PV / высокоскоростным выпускным клапаном (HVVV), соответствуют требованиям согласно требованиям Правил 11 главы II-2 Конвенции СОЛАС, разделов 6.3.2, 6.3.4 и 6.4. Первичная система вентиляции на судах осуществляется через стояк главной мачты IG, защищенный полнопоточным P / V-выключателем. Вторичная вентиляция осуществляется через. Индивидуальный грузовой танк P / V Клапаны, которые имеют индивидуальную полную пропускную способность.
Клапаны PV (давление-вакуум) / HV (высокая скорость)
Техническое обслуживание грузовых танков PV / HVVV должно производиться в соответствии с PMS.Такой отчет о техническом обслуживании с использованием PV-клапанов грузовых танков и соответствующая корреспонденция должны храниться на борту.
во время рейса с грузом
В грузовых танках должно поддерживаться положительное давление. В нормальных условиях нет необходимости запускать IGS во время рейса с грузом. Более того, из-за образования углеводородов уровень кислорода внутри резервуаров будет значительно ниже уровней до загрузки (в условиях пустого резервуара), при условии, что не произойдет проникновение воздуха.Если отделение паров не требуется, давление в резервуаре подключается к стандартной линии IG и может контролироваться из центрального пункта. (Навигационный мостик или пункт управления грузами).
Имейте в виду, что во время внезапного падения температуры окружающей среды воздух может попасть в грузовые масляные танки через клапаны P / V на каждом грузовом масляном танке, увеличивая уровень O2. В целях проявления должной осмотрительности от имени перевозчика после завершения погрузки Журнал учета давления IGS должен оставаться в постоянном действии для выполнения рейса регистрации давления IG в грузовом танке.Если требуется поддерживать разделение паров между сортами, давление в разделенных резервуарах следует контролировать часто (не более четырех часовых интервалов). Этот интервал должен быть сокращен в зависимости от характера груза (склонность к газификации при поддерживаемой температуре), процента наполнения и температуры.
Проблемы при работе и отказ IGS во время операций разгрузки / COW
Если система инертного газа (IGS) неисправна во время работы, операции по перекачке масла должны быть немедленно приостановлены и не возобновляться, пока IGS не будет в хорошем рабочем состоянии (или) предоставляется альтернативная подача инертного газа.Такое аварийное действие в случае отказа системы инертного газа требуется для поддержания положительного давления в грузовых или отстойных танках. Главный запорный клапан инертного газа должен быть закрыт. В этом случае необходимо как можно скорее проинформировать терминал.
Прочие операции
Чтобы использовать IGS для операций по очистке резервуаров, дегазации и промывке сырой нефтью, необходимо соблюдать особую осторожность в каждой процедуре.
Записи
Следующие записи должны храниться на борту не менее 5 лет:
Дополнительная литература:
Обработка нефтеналивных грузов с температурой вспышки выше 60 ° C
Связанные статьи
Прочие информационные страницы!
Суда Чартерные партии Связанные термины и руководство
Травмы грузчиков Как предотвратить травмы на борту
Проблемы окружающей среды Как предотвратить загрязнение моря
Указания по безопасности при погрузке-разгрузке грузов и балласта
Обработка рефрижераторных грузов Устранение неисправностей и контрмеры
Правила обращения с грузами DG
Безопасность двигателя комната Стандартные процедуры
Вопросы пользователей и отзывы Прочтите нашу базу знаний
Домашняя страница
КораблиБизнес.com — это просто информационный сайт о различных аспектах эксплуатации судов, порядка обслуживания,
предотвращение загрязнения и многие рекомендации по безопасности. Описанные здесь процедуры являются только ориентировочными,
не является исчерпывающим по своему характеру, и всегда следует руководствоваться практикой хорошего мореплавания.
Отзывы пользователей
важно обновить нашу базу данных.


 {2}}{3*V}\)
{2}}{3*V}\)
 1
1
 Расстояние, например, между точками A и C уменьшается и уже на изотерме 2 они сливаются в одну точку – точку К перегиба. В точке перегиба изобара является касательной к изотерме. Температура Tк, соответствующая этой изотерме называется критической температурой.
Расстояние, например, между точками A и C уменьшается и уже на изотерме 2 они сливаются в одну точку – точку К перегиба. В точке перегиба изобара является касательной к изотерме. Температура Tк, соответствующая этой изотерме называется критической температурой. Метастабильные состояния существуют ограниченное время. Чтобы получить такое метастабильное состояние как перегретый пар необходимо отсутствие в газе инородных и смачиваемых включений, которые являются центрами конденсации. Перегретой может быть только очень чистая жидкость, в которой нет зародышей газовой фазы. Как правило, они всегда присутствуют в виде мельчайших пузырьков на стенках сосуда, содержащего жидкость, или на взвешенных в жидкости пылинках.
Метастабильные состояния существуют ограниченное время. Чтобы получить такое метастабильное состояние как перегретый пар необходимо отсутствие в газе инородных и смачиваемых включений, которые являются центрами конденсации. Перегретой может быть только очень чистая жидкость, в которой нет зародышей газовой фазы. Как правило, они всегда присутствуют в виде мельчайших пузырьков на стенках сосуда, содержащего жидкость, или на взвешенных в жидкости пылинках. При температурах ниже критической есть участок насыщения, и вещество может переходить из газообразного состояния в жидкое состояние (область I, рис. 3). Температурам выше критической соответствует только газообразное состояние (область II, рис. 3). Область III, примыкающая к оси ординат (рис. 3), относится к жидкому состоянию системы.
При температурах ниже критической есть участок насыщения, и вещество может переходить из газообразного состояния в жидкое состояние (область I, рис. 3). Температурам выше критической соответствует только газообразное состояние (область II, рис. 3). Область III, примыкающая к оси ординат (рис. 3), относится к жидкому состоянию системы.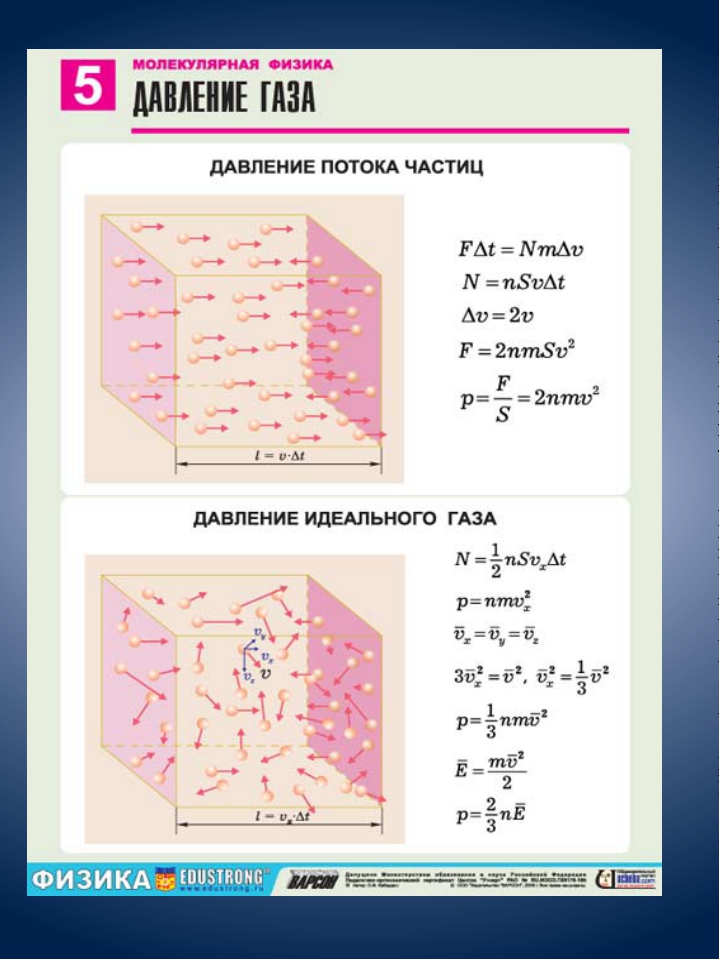
 2. любая такая жидкость или смесь жидкостей. 3. любой…… Универсал
2. любая такая жидкость или смесь жидкостей. 3. любой…… Универсал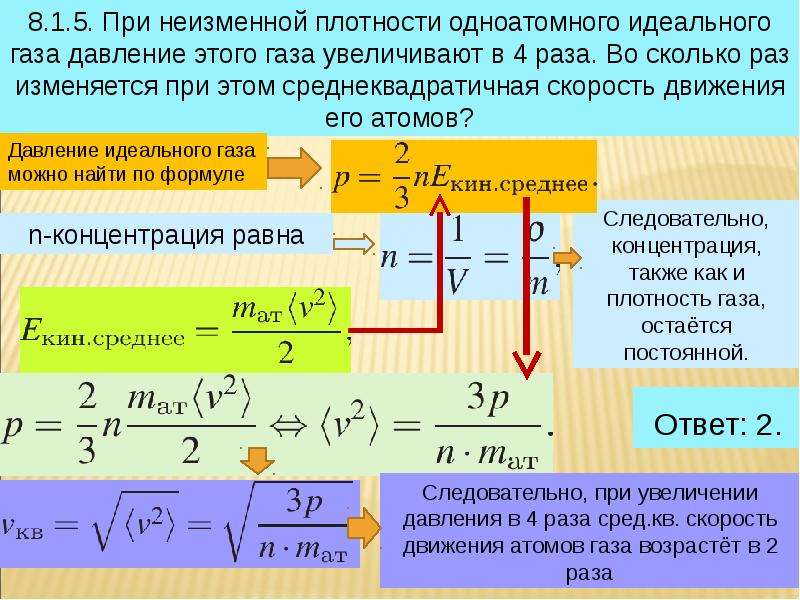 Перепад давления опасен и многие смертельны…… Wikipedia
Перепад давления опасен и многие смертельны…… Wikipedia Изучение внутренней баллистики важно для разработчиков и пользователей…… Wikipedia
Изучение внутренней баллистики важно для разработчиков и пользователей…… Wikipedia Давления
Давления  B Давление, которое оказывает горизонтально лежащий текст, составляет
B Давление, которое оказывает горизонтально лежащий текст, составляет 2 )?
2 )?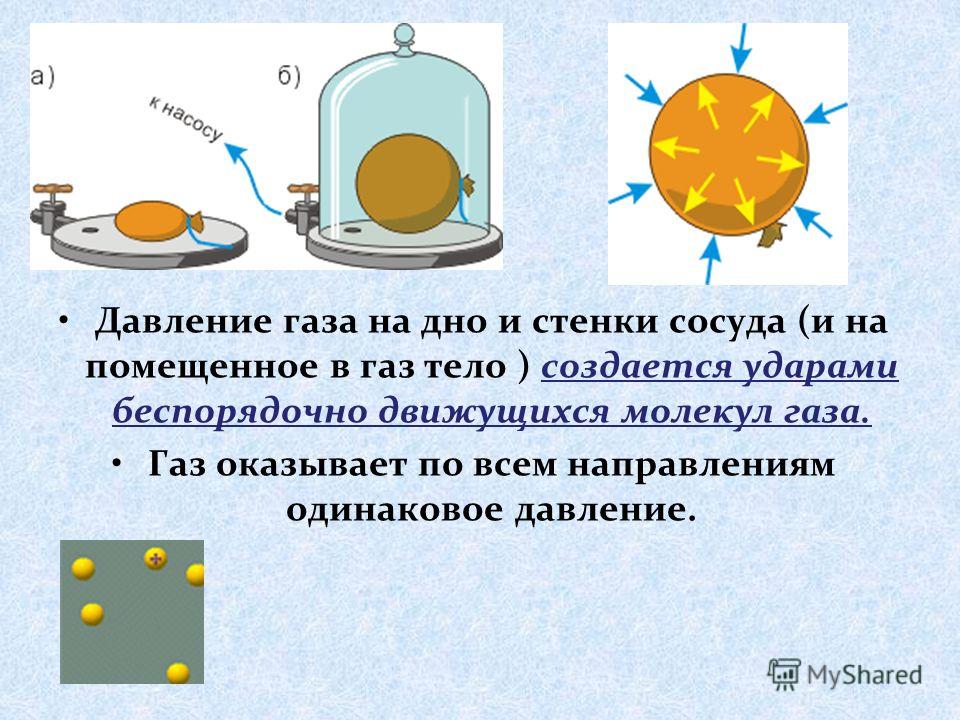
 0 м 2 поршень ?
0 м 2 поршень ?
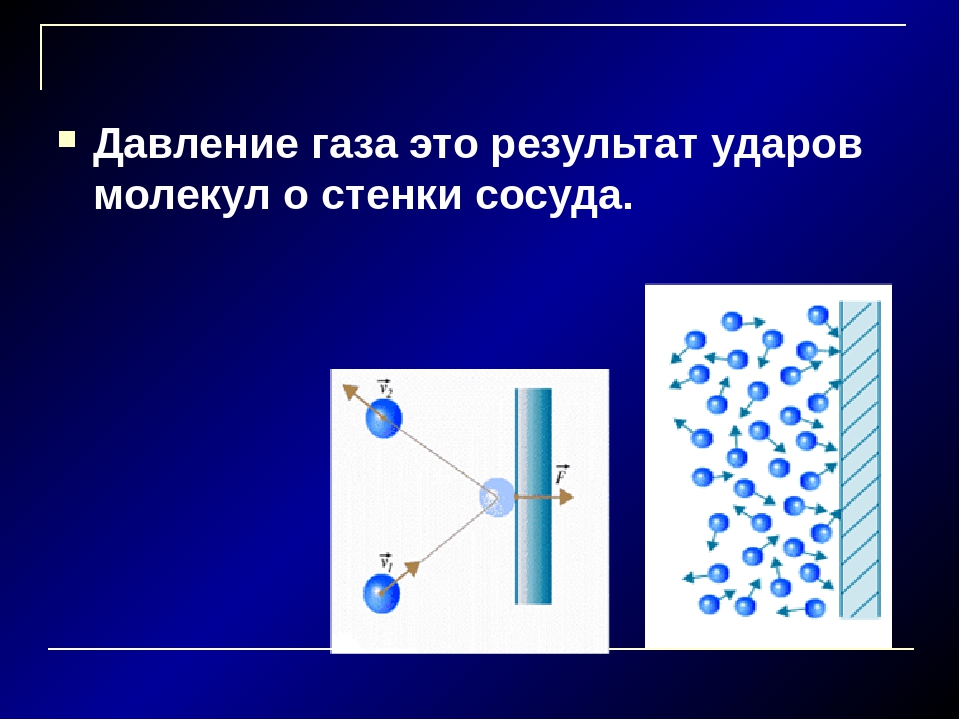
 Ст.
Ст. Какая масса в килограммах, приложенная к площади 1,0 см 2 , требуется для создания давления
Какая масса в килограммах, приложенная к площади 1,0 см 2 , требуется для создания давления 785
785 / сек) на 1 м 2
/ сек) на 1 м 2  S.) (т.е. манометр емкости 1000 Торр = от 1000 до 0,1 Торр, манометр емкости 0,1 Торр = от 0,1 до 1e -5 Торр)
S.) (т.е. манометр емкости 1000 Торр = от 1000 до 0,1 Торр, манометр емкости 0,1 Торр = от 0,1 до 1e -5 Торр)